Hidrogênio (H): dados, características e para que serve
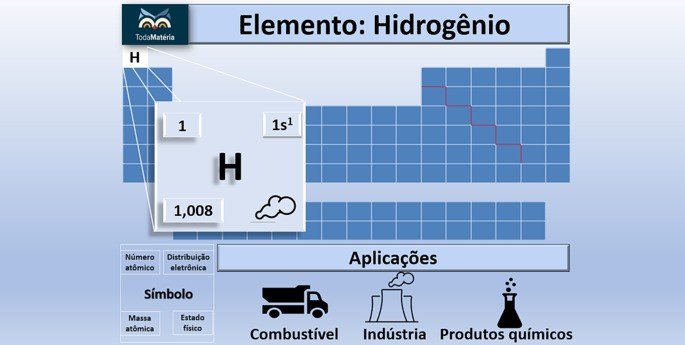
O hidrogênio é o elemento químico de símbolo H e número atômico 1 da tabela periódica. Trata-se do elemento mais simples conhecido, cujo átomo é formado apenas por um próton e nenhum nêutron.
Embora esteja localizado no primeiro período e acima dos metais alcalinos (grupo 1), este elemento não é um metal. Ele também não se enquadra em nenhum outro grupo, pois não apresenta características físicas e químicas semelhantes aos demais elementos.
A posição do hidrogênio na tabela periódica deve-se à sua distribuição eletrônica 1s1, ou seja, o átomo apresenta um elétron na eletrosfera.
A massa atômica do hidrogênio é 1,008 u. Ela é obtida a partir da média ponderada da massa de seus isótopos deutério, trítio e prótio.
A palavra "hidrogênio", de origem grega, é composta pelos termos hydro e genes e significa gerador de água.
Características do hidrogênio
Quando dois átomos de hidrogênio se ligam, formam a molécula H2, conhecida como gás hidrogênio. Trata-se de uma substância gasosa, inflamável, incolor, inodora, não metálica e insolúvel em água.
O ponto de fusão do hidrogênio molecular é -259,2 ºC e o ponto de ebulição é -252,9 º C. Devido às suas características, principalmente a capacidade de armazenar energia, essa substância é utilizada como combustível.
O elemento hidrogênio é raro na atmosfera terrestre, posto que sua densidade muito leve o permite escapar à gravidade da Terra.
Todavia, é abundante na superfície do planeta, na forma de hidrocarbonetos, como os componentes do petróleo, e água. Por isso, é o quarto elemento mais abundante da Terra, atrás apenas de oxigênio, silício e alumínio.
O mesmo é o mais abundante dos elementos químicos do Universo, pois é o principal componente de estrelas, como o Sol. Geralmente, pode ser encontrado no estado atômico e na forma de plasma, estimando cerca de 75% da massa elementar, cujas propriedades são distintas daquela do hidrogênio molecular ou gás hidrogênio (H2).
O hidrogênio, produz compostos com muitos elementos da Tabela Periódica, especialmente os compostos orgânicos, formados em combinação com o carbono.
Saiba mais sobre tabela periódica.
Para que serve o hidrogênio?
O elemento hidrogênio faz parte da composição dos seres vivos, pois está presente em moléculas orgânicas, como carboidratos, proteínas e lipídios, além de compor a substância vital água (H2O).
O hidrogênio era utilizado como gás de balões e dirigíveis. Isso porque ele é mais leve do que o ar, mas foi substituído pelo hélio, elemento menos inflamável.
Atualmente, o hidrogênio é empregado em uma variada gama de produções de produtos químicos. São exemplos a obtenção do amoníaco para fertilizantes, o metanol, a hidrogenação do carvão e a soldadura.
Acresce, ainda, a sua utilização como redutor para a obtenção de metais, devido à solubilidade e características do hidrogênio, o qual pode ocasionar fragilidade em muitos elementos metálicos.
Em estado líquido, é empregado como carburante para foguetes e para o aprimoramento de combustíveis fósseis em geral.
Saiba mais sobre fontes de energia.
Isótopos do hidrogênio
Os isótopos são átomos de um elemento químico e, por isso, apresentam o mesmo número atômico, mas diferem no número de massa.
Há três principais tipos de isótopos de hidrogênio. São eles:

Prótio (contém 1 próton), Deutério (contém 1 próton e 1 nêutron) e Tritío (contém 1 próton e 2 nêutrons), os quais são representados da seguinte forma:
| Prótio | Deutério | Trítio |
|---|---|---|
|
1 próton 1 elétron 0 nêutron |
1 próton 1 elétron 1 nêutron |
1 próton 1 elétron 2 nêutrons |
Os números sobrescritos representam o número de massa de cada átomo, que é dado pela soma de prótons e nêutrons.
Produção e obtenção do hidrogênio
Industrialmente, o hidrogênio é produzido a partir de hidrocarbonetos, como gás natural, metano, gasolina e diesel. Ele também pode ser obtido de outras fontes, como etanol, metanol e água.
O processo de "steam reforming", onde a alta temperatura em que o gás natural, como o metano (CH4), um composto formado por carbono e hidrogênio, é contatado com vapor de água (H2O) produz o elemento em estado puro.
CH4 + H2O → CO2 + H2
A produção do mesmo em laboratório é feita atacando metais, como o zinco (Zn), com ácido clorídrico diluído (HCl) através de uma reação de simples troca.
2Zn + 2HCl → 2ZnCl + H2
Outra forma muito usual de obtenção do hidrogênio no Brasil e outros países é com o uso da eletricidade através da decomposição eletrolítica de uma dissolução aquosa em sal comum.
Com a passagem de corrente elétrica, ocorre uma reação de oxirredução e a eletrólise da água produz como um dos produtos o gás hidrogênio.
H2O → O2 + H2
História da descoberta
O gás hidrogênio foi produzido artificialmente por T. Von Hohenheim (Paracelso, 1493-1541) quando este estudava a reação química entre metais e ácidos fortes.
Contudo, será Henry Cavendish o primeiro a perceber, em 1781, a real natureza do gás. Ele o identificou numa reação ácido-metal como gás inflamável, a qual o produz água quando queimado.
Mais tarde, em 1783, Antoine Lavoisier batizou o elemento como hidrogênio. A aplicação prática do gás pode ter sido com o primeiro balão de gás hidrogênio, de 1783, o qual se difundiu como forma de transporte, até que um acidente mostrou o risco envolvido.
Curiosidades
- O H2 é mais leve que o ar e foi utilizado em dirigíveis rígidos pelo conde alemão Ferdinand von Zeppelin, daí o nome dos dirigíveis;
- O gás de hidrogênio pode ser sintetizado por algumas bactérias e algas;
- O hidrogênio é estudado para futuramente ser utilizado na produção de combustível de energia limpa;
- O gás metano (CH4) é uma fonte de hidrogênio de crescente importância.
Sabe qual é a bomba atômica mais potente do Universo? Leia bomba de hidrogênio.
Referências Bibliográficas
ATKINS, P.W.; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006.
FELTRE, Ricardo. Fundamentos de Química: vol. único. 4ª.ed. São Paulo: Moderna, 2005.
Lee, J. D. Química inorgânica não tão concisa. Tradução da 5ª ed. inglesa. Editora Edgard Blücher Ltda. 1999.
BATISTA, Carolina. Hidrogênio (H): dados, características e para que serve. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/hidrogenio/. Acesso em:

