O que é pH?
O pH corresponde ao potencial hidrogeniônico de uma solução. Ele é determinado pela concentração de íons de hidrogênio (H+) e serve para medir o grau de acidez, neutralidade ou alcalinidade de determinada solução.
Além do pH existe também outra grandeza que determina a acidez e a basicidade de um sistema aquoso: o pOH (potencial hidroxiliônico). Essa escala possui a mesma função que o pH, embora seja menos utilizada.
Escala de pH
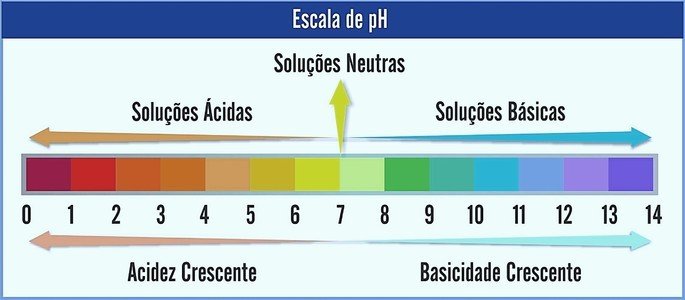
O pH é representado numa escala que varia de 0 a 14. Ela mede a acidez e basicidade de uma solução.
Sendo assim, o pH 7 representa uma solução neutra (por exemplo, a água pura). Já os que estão antes dele são consideradas soluções ácidas (pH ácido), e os que estão após o 7 são as soluções básicas (pH alcalino).
Feita essa observação, o caráter ácido é crescente da direita para a esquerda. Já o caráter básico, da esquerda para a direita. Note que, quanto menor o valor do pH mais ácida será a solução.
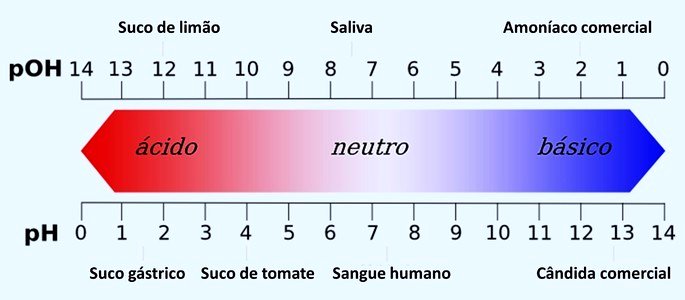
Saiba mais em:
Exemplos
Soluções Ácidas
| Solução | pH |
|---|---|
| Suco gástrico | 2,0 |
| Suco de limão | 2,2 |
| Vinagre | 3,0 |
| Café | 5,0 |
| Leite de vaca | 6,4 |
Soluções Básicas
| Solução | pH |
|---|---|
| Sangue humano | 7,35 |
| Água do mar | 7,4 |
| Bicarbonato de sódio | 8,4 |
| Leite de magnésia | 10,5 |
| Alvejante | 12,5 |
Como calcular o pH?
Em 1909, o químico dinamarquês Soren Sörensen (1868-1939) propôs que a acidez das soluções, medida em termos das concentrações de íons H+, tivesse seus valores transformados utilizando logaritmos para facilitar a compreensão.
Na temperatura de 25 ºC o produto iônico da água é igual a 10–14 mol2/L2.
Aplicando o cologaritmo na expressão, temos que:
Através dessa expressão, podemos obter o valor corresponde de uma escala em outra através da subtração.
Como medir o pH?
O controle do pH é importante não só para fins científicos, mas também no cotidiano.
O pH da piscina precisa ser verificado, assim como o pH do aquário e até mesmo o pH do solo para possibilitar certos tipos de plantações.
Veja a seguir as principais formas de medir o pH.
Indicador ácido-base
Os chamados indicadores ácidos-bases são utilizados para medir o pH de uma solução. Eles são substâncias que mudam de cor indicando o caráter da solução. Os indicadores mais utilizados são: o tornassol e a fenolftaleína.

Peagâmetro
Além dos indicadores, o pH de uma solução pode ser medida através de um instrumento chamado de peagâmetro. Esse aparelho eletrônico mede a condutividade elétrica da solução e converte para a escala dos valores de pH.

Exercícios de Vestibular com Gabarito
1. (Enem/2014) Um pesquisador percebe que o rótulo de um dos vidros em que guarda um concentrado de enzimas digestivas está ilegível. Ele não sabe qual enzima o vidro contém, mas desconfia que seja uma protease gástrica, que age no estômago digerindo proteínas.
Sabendo que a digestão no estômago é ácida e no intestino é básica, ele monta cinco tubos de ensaio com alimentos diferentes, adiciona o concentrado de enzimas em soluções com pH determinado e aguarda para ver se a enzima age em algum deles.
O tubo de ensaio em que a enzima deve agir para indicar que a hipótese do pesquisador está correta é aquele que contém:
a) cubo de batata em solução com pH = 9
b) pedaço de carne em solução com pH = 5
c) clara de ovo cozida em solução com pH = 9
d) porção de macarrão em solução com pH = 5
e) bolinha de manteiga em solução com pH = 9
2. (Udesc/2009) "Chuva ácida" é um termo que se refere à precipitação, a partir da atmosfera, de chuva com quantidades de ácidos nítrico e sulfúrico maiores que o normal.
Os precursores da chuva ácida vêm tanto de fontes naturais, tais como vulcões e vegetação em decomposição, quanto de processos industriais, principalmente emissões de dióxido de enxofre e óxidos de nitrogênio resultantes da queima de combustíveis fósseis.
O pH da água da chuva considerado normal é de 5,5 (devido à presença de ácido carbônico proveniente da solubilização de dióxido de carbono). Um químico monitorando uma região altamente industrializada observou que o pH da água da chuva era igual a 4,5.
Considerando que a acidez está relacionada com a concentração de H3O+, é correto afirmar que a água com pH 4,5 era:
a) duas vezes mais básica que o normal.
b) duas vezes mais ácida que o normal.
c) dez vezes mais básica que o normal.
d) dez vezes mais ácida que o normal.
e) cem vezes mais ácida que o normal.
3. (UFMG/2009) Considere certa quantidade de água e suco de limão, misturados, contida em um copo. Analise estas três afirmativas concernentes a esse sistema:
I. O sistema é ácido.
II. O pH do sistema é maior que 7.
III. No sistema, a concentração dos íons H+ é maior que a dos OH–.
A partir dessa análise, é CORRETO afirmar que:
a) apenas as afirmativas I e II estão certas.
b) apenas as afirmativas I e III estão certas.
c) apenas as afirmativas II e III estão certas.
d) as três afirmativas estão certas.
Para mais questões, com resolução comentada, não deixe de conferir: Exercícios sobre pH e pOH.
BATISTA, Carolina. O que é pH?. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/o-que-e-ph/. Acesso em:

