Reações Químicas
As reações químicas são o resultado da transformação que ocorre nas substâncias, onde os átomos rearranjam-se modificando seu estado inicial.
Assim, os compostos químicos sofrem alterações gerando novas moléculas. Por sua vez, os átomos dos elementos permanecem inalterados.
Tipos de reações químicas
As reações químicas (com presença de substâncias reagentes e resultantes) são classificadas de quatro maneiras, a saber:
Reações de síntese ou adição
Reações entre duas substâncias reagentes que resultam em uma mais complexa.
| Representação | A + B → AB |
|---|---|
| Exemplo |
Síntese do gás carbônico: C + O2 → CO2 |
Reações de análise ou de decomposição
Reações em que uma substância reagente se divide em duas ou mais substâncias simples. Essa decomposição pode ocorrer de três maneiras:
- pirólise (decomposição pelo calor)
- fotólise (decomposição pela luz)
- eletrólise (decomposição pela eletricidade)
| Representação | AB → A + B |
|---|---|
| Exemplo |
Decomposição do óxido de mercúrio: 2HgO → 2Hg + O2 |
Reações de deslocamento
Também chamadas de substituição ou de simples troca, são reações entre uma substância simples e outra composta, levando à transformação da substância composta em simples.
| Representação | AB + C → AC + B ou AB + C → CB + A |
|---|---|
| Exemplo |
Simples troca entre ferro metálico e ácido clorídrico: Fe + 2HCl → H2 + FeCl2 |
Reações de dupla-troca ou dupla substituição
São reações entre duas substâncias compostas que permutam entre si os elementos químicos, gerando duas novas substâncias compostas.
| Representação | AB + CD → AD + CB |
|---|---|
| Exemplo |
Dupla troca entre cloreto de sódio e nitrato de prata: NaCl + AgNO3 → AgCl + NaNO3 |
Quando Ocorre uma Reação Química?
Dependendo da condição de temperatura, concentração de substâncias e do contato entre elementos químicos envolvidos, as reações químicas podem ocorrer de maneira rápida ou lenta.
As reações gasosas, por exemplo, são rápidas, pois as moléculas conseguem se mover rapidamente e se chocarem. Já as reações entre componentes líquidos e sólidos são lentas.
Sendo assim, uma reação química ocorre quando duas ou mais substâncias entram em contato, gerando ligações químicas, que resultam em uma nova substância. Para que ela ocorre, os reagentes presentes nas reações químicas devem ter afinidade química para reagirem.
Note que as reações químicas endotérmicas absorvem energia, visto que a energia química ou entalpia dos reagentes é menor que a dos produtos.
As reações químicas exotérmicas, por sua vez, liberam energia, pois a energia química dos reagentes é maior que a dos produtos.
Reações de oxirredução
As reações de oxirredução ocorrem entre metais (tendência para ceder elétrons) e não metais (tendência para receber elétrons). Como exemplo, podemos citar a oxidação (ferrugem) que surgem nos metais com o passar do tempo.
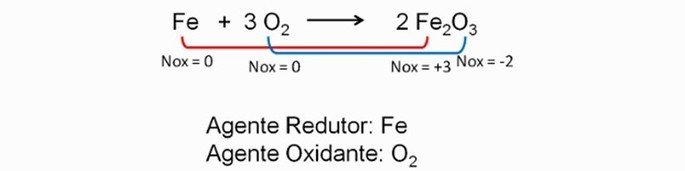
Nesse sentido, vale lembrar que a maioria das reações químicas ocorrem entre substâncias de caraterísticas opostas. Por exemplo: substâncias de caráter oxidante e redutor ou as substâncias de caráter ácido e básico.
Para adquirir mais conhecimento, leia esses textos:
Outras reações químicas
Por sua vez, as reações que não são de oxirredução podem ocorrer de três maneiras e geralmente são reações de dupla troca:
- Quando um dos produtos for menos solúvel que os reagentes, por exemplo, entre o cloreto de sódio (NaCl) e o nitrato de prata (AgNO3): NaCl + AgNO3 → AgCl + NaNO3
- Quando um dos produtos for mais volátil que os reagentes, por exemplo, entre o cloreto de sódio (NaCl) e o ácido sulfúrico (H2SO4): 2NaCl + H2SO4 → Na2SO4 + 2 HCl
- Quando um dos produtos for menos ionizável que os reagentes, por exemplo, entre o ácido clorídrico (HCl), composto ionizável, e o hidróxido de sódio (NaOH), composto iônico, o qual resulta num composto iônico (sal) e um composto molecular (água): HCl + NaOH → NaCl + H2O
Saiba mais em:
Exemplos de Reações Químicas
Para ver como as reações químicas estão presentes no dia a dia, segue abaixo alguns exemplos:
- Processo de digestão
- Preparação de alimentos
- Combustão dos veículos
- Aparecimento da ferrugem
- Fabricação de remédios
- Registro fotográfico
- Extintor de incêndio
- Queima da parafina da vela
- Explosão
Equações Químicas
A forma encontrada para demonstrar graficamente os fenômenos químicos foi através de equações químicas.
Veja a reação de formação da água.
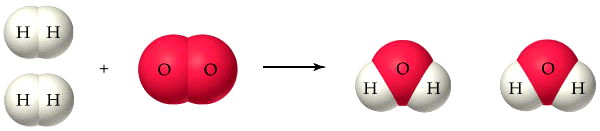
Observe que as moléculas de hidrogênio (H2) e oxigênio (O2) vão "desaparecer" e darão lugar às moléculas de água (H2O). Embora os reagentes e os produtos sejam diferentes, o número de átomos é o mesmo.
Essa reação química é representada da seguinte forma:
A equação química apresenta as fórmulas das substâncias (H2, O2 e H2O) e os coeficientes estequiométricos (2, 1 e 2) determinam a quantidade reagiu e que foi produzida na reação química.
Outro exemplo de reação química são as equações iônicas, ou seja, quando envolve substâncias iônicas (íons), além de átomos e moléculas:
Essa equação simplificada indica que um ácido forte, como o ácido clorídrico (HCl) que possui um íon H+, reagiu com uma base forte, como o hidróxido de sódio (NaOH) portador do íon OH-, e ao reagirem formaram água.
Com isso, podemos perceber que uma equação química representa de forma abreviada como ocorre uma reação.
Para entender melhor o tema, confira esses textos:
Exercício Resolvido
As equações químicas são representações das reações químicas que ocorrem entre os elementos da tabela periódica. Segundo o tipo de união entre os átomos que interagem entre si elas podem ser de: síntese, análise, deslocamento ou dupla troca. Feita essa observação, assinale a alternativa correta quanto aos tipos de reações químicas:
a) Reação de Análise ou Decomposição: 2Cu(NO3)2 → 2CuO + 4NO2 + O2
b) Reação de Síntese ou Adição: 2KClO3 → 2KCl + O3
c) Reação de Dupla Troca ou de Dupla Substituição: Fe + CuSO4→ Cu + FeSO4
d) Reação de Deslocamento ou Simples Troca: CaO + H2O → Ca(OH)2
e) Reação de Análise ou Decomposição: FeS + 2HCl → FeCl2 + H2S
Para mais exercícios com gabarito comentado, veja também:
- Exercícios sobre Balanceamento de Equações Químicas
- Exercícios sobre Estequiometria
- Exercícios sobre Termoquímica
- Exercício de Química (2ª série)
BATISTA, Carolina. Reações Químicas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/reacoes-quimicas/. Acesso em:

