Forças intermoleculares
Forças intermoleculares são as forças exercidas para manter unidas duas ou mais moléculas.
Elas correspondem a ligações químicas que têm a função de unir ou repelir as moléculas de um composto.
As forças intermoleculares provocam estados físicos diferentes nos compostos químicos. Essa interação pode ser mais ou menos forte, conforme a polaridade das moléculas.
Classificação
As forças intermoleculares são classificadas em três tipos que variam conforme a intensidade:
- Ligação de Hidrogênio: Ligação de forte intensidade.
- Dipolo Permanente ou dipolo-dipolo: Ligação de média intensidade.
- Dipolo Induzido ou Forças de London: Ligação de fraca intensidade.
O conjunto das forças intermoleculares também pode ser chamado de Forças de Van der Waals.
Ligação de Hidrogênio
A ligação ou ponte de hidrogênio ocorre em moléculas polares que têm o hidrogênio unido à elementos eletronegativos e com volume atômico baixo, como o oxigênio (O), flúor (F) e nitrogênio (N).
É a força intermolecular mais forte, pois existe uma grande diferença de eletronegatividade entre os elementos.
Um exemplo de ligação de hidrogênio ocorre na molécula de água (H2O) nos estados sólido e líquido.
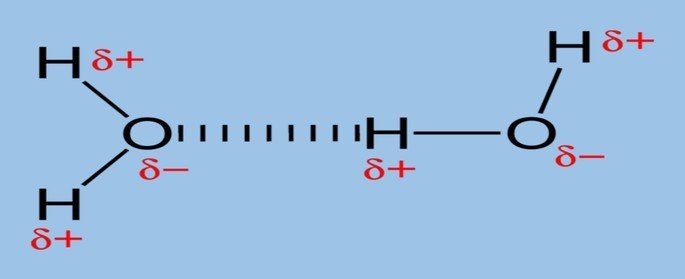
Na água líquida essa interação ocorre de forma desordenada, enquanto que no gelo as moléculas dispõem-se tridimensionalmente em uma estrutura cristalina organizada.
Para adquirir mais conhecimento, leia também esses textos:
Dipolo-dipolo
O dipolo-dipolo ocorre entre as moléculas dos compostos polares e é considerada uma interação de força intermediária.
Os elétrons estão distribuídos de forma assimétrica e assim o elemento mais eletronegativo atrai os elétrons para si.
Nas ligações dipolo-dipolo, as moléculas polares interagem de maneira que os polos opostos sejam preservados.

Com o exemplo acima, podemos perceber que a interação dipolo-dipolo ocorre devido à atração entre os polos de carga oposta.
O polo negativo (cloro) atrai o polo positivo (hidrogênio) da molécula vizinha.
Dipolo induzido
O dipolo induzido é constituído pela atração não gravitacional que ocorre em todas as moléculas e é o único tipo de atração entre moléculas apolares.
Os elétrons estão distribuídos de forma uniforme e não há formação de dipolo elétrico. Porém, quando as moléculas apolares se aproximam induzem a formação de dipolos temporários.

Nos estados físicos sólido e líquido, as moléculas estão tão próximas que forma-se uma deformação instantânea das nuvens eletrônicas e originam-se polos positivo e negativo.
Forças intermoleculares x Forças intramoleculares
É importante saber que as forças intermoleculares são um tipo de ligações químicas. As demais são as "forças intramoleculares".
Assim, as forças intermoleculares são exercidas entre as moléculas e as intramoleculares no interior das moléculas.
As forças intramoleculares são:
Iônica
A ligação iônica é considerada uma ligação química forte. Ela é produzida pela atração eletrostática entre íons de cargas diferentes (+ e -).

Consiste na relação estabelecida entre metal e não-metal por meio da transferência de elétrons.
Covalente
As forças que produzem a ligação covalente resultam na partilha de pares de elétrons entre dois átomos de não-metais.

A maior parte dos compostos covalentes tem pontos de ebulição e fusão baixos, são pouco solúveis em água e dissolvem-se com facilidade em solventes apolares.
Metálica
A ligação metálica resulta das forças exercidas no interior das moléculas de substâncias metálicas.

Os metais têm poucos elétrons de valência, sendo bons condutores de eletricidade, calor e refletem a radiação.
Exercícios com gabarito comentado
1. (UFPE-Adaptado) Interações intermoleculares são propriedades de diversas moléculas, muitas delas vitais para os seres vivos, tais como as moléculas de água e de proteínas. Sobre esse assunto, julgue os itens a seguir:
a) O álcool etílico (etanol) apresenta interações do tipo ligações de hidrogênio.
b) A molécula de água apresenta interações do tipo ligações de hidrogênio.
c) A molécula de água apresenta interações do tipo dipolo-dipolo.
d) A molécula de dióxido de carbono apresenta interações do tipo dipolo induzido.
2. (PUC-RS-Adaptado) Para responder à questão, numere a Coluna B, que contém algumas fórmulas de substâncias, de acordo com a Coluna A, na qual estão relacionados tipos de atrações intermoleculares.
| Coluna A | Coluna B |
|---|---|
| 1. ligações de hidrogênio | HF |
| Cl2 | |
| CO2 | |
| 2. dipolo induzido-dipolo induzido | NH3 |
| HCl | |
| SO2 | |
| 3. dipolo-dipolo | BF3 |
| CCl4 |
3. (Unicamp) Considere os processos I e II representados pelas equações:
Indique quais ligações são rompidas em cada um desses processos.
Saiba mais em: hidrogênio e oxigênio.
BATISTA, Carolina. Forças intermoleculares. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/forcas-intermoleculares/. Acesso em:



