Exercícios para o ENEM (120)
Foram encontradas 6013 questões
A remoção de petróleo derramado em ecossistemas marinhos é...
A remoção de petróleo derramado em ecossistemas marinhos é complexa e muitas vezes envolve a adição de mais sustâncias ao ambiente. Para facilitar o processo de recuperação dessas áreas, pesquisadores têm estudado a bioquímica de bactérias encontradas em locais sujeitos a esse tipo de impacto. Eles verificaram que algumas dessas espécies utilizam as moléculas de hidrocarbonetos como fonte energética, atuando como biorremediadores, removendo o óleo do ambiente.
KREPSKY, N.; SILVA SOBRINHO, F.; CRAPEZ, M. A. C. Ciência Hoje, n. 223, jan.-fev. 2006 (adaptado).
Para serem eficientes no processo de biorremediação citado, as espécies escolhidas devem possuir
células flageladas, que capturem as partículas de óleo presentes na água.
altas taxas de mutação, para se adaptarem ao ambiente impactado pelo óleo.
enzimas, que catalisem reações de quebra das moléculas constituintes do óleo.
parede celular espessa, que impossibilite que as bactérias se contaminem com o óleo.
Os calcários são materiais compostos por carbonato de cálcio, que...
Os calcários são materiais compostos por carbonato de cálcio, que podem atuar como sorventes do dióxido de enxofre (SO2 ), um importante poluente atmosférico. As reações envolvidas no processo são a ativação do calcário, por meio de calcinação, e a fixação do SO2 com a formação de um sal de cálcio, como ilustrado pelas equações químicas simplificadas.
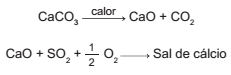
Considerando-se as reações envolvidas nesse processo
de dessulfurização, a fórmula química do sal de cálcio
corresponde a
CaSO3 .
CaSO4.
CaS2O8 .
CaSO2 .
CaS2O7 .
Uma enzima foi retirada de um dos órgãos do sistema digestório de...
Uma enzima foi retirada de um dos órgãos do sistema digestório de um cachorro e, após ser purificada, foi diluída em solução fisiológica e distribuída em três tubos de ensaio com os seguintes conteúdos:
• Tubo 1: carne
• Tubo 2: macarrão
• Tubo 3: banha
Em todos os tubos foi adicionado ácido clorídrico (HCl), e o pH da solução baixou para um valor próximo a 2. Além disso, os tubos foram mantidos por duas horas a uma temperatura de 37 °C. A digestão do alimento ocorreu somente no tubo 1.
De qual órgão do cachorro a enzima foi retirada?
Fígado.
Pâncreas.
Estômago.
Vesícula biliar.
Intestino delgado.
A obtenção de sistemas coloidais estáveis depende das interações...
A obtenção de sistemas coloidais estáveis depende das interações entre as partículas dispersas e o meio onde se encontram. Em um sistema coloidal aquoso, cujas partículas são hidrofílicas, a adição de um solvente orgânico miscível em água, como etanol, desestabiliza o coloide, podendo ocorrer a agregação das partículas preliminarmente dispersas.
A desestabilização provocada pelo etanol ocorre porque
a polaridade da água no sistema coloidal é reduzida.
as cargas superficiais das partículas coloidais são diminuídas.
as camadas de solvatação de água nas partículas são diminuídas.
o processo de miscibilidade da água e do solvente libera calor para o meio.
a intensidade dos movimentos brownianos das partículas coloidais é reduzida.
Dentre outras características, uma determinada vegetação apresenta...
Dentre outras características, uma determinada vegetação apresenta folhas durante três a quatro meses ao ano, com limbo reduzido, mecanismo rápido de abertura e fechamento dos estômatos e caule suculento. Essas são algumas características adaptativas das plantas ao bioma onde se encontram.
Que fator ambiental é o responsável pela ocorrência dessas características adaptativas?
Escassez de nutrientes no solo.
Estratificação da vegetação.
Elevada insolação.
Baixo pH do solo.
Escassez de água.
A rede elétrica de uma residência tem tensão de 110 V e o morador...
A rede elétrica de uma residência tem tensão de 110 V e o morador compra, por engano, uma lâmpada incandescente com potência nominal de 100 W e tensão nominal de 220 V.
Se essa lâmpada for ligada na rede de 110 V, o que acontecerá?
O avanço tecnológico da medicina propicia o desenvolvimento de...
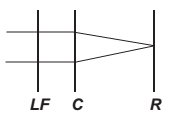
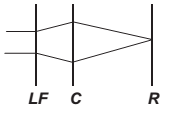
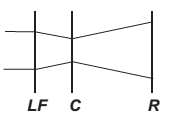
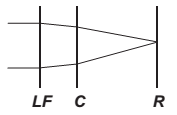
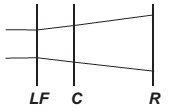
O avanço tecnológico da medicina propicia o desenvolvimento de tratamento para diversas doenças, como as relacionadas à visão. As correções que utilizam laser para o tratamento da miopia são consideradas seguras até 12 dioptrias, dependendo da espessura e curvatura da córnea. Para valores de dioptria superiores a esse, o implante de lentes intraoculares é mais indicado. Essas lentes, conhecidas como lentes fácicas (LF), são implantadas junto à córnea, antecedendo o cristalino (C), sem que esse precise ser removido, formando a imagem correta sobre a retina (R).
O comportamento de um feixe de luz incidindo no olho que possui um implante de lentes fácicas para correção do problema de visão apresentado é esquematizado por
O papel tem na celulose sua matéria-prima, e uma das etapas de sua...
O papel tem na celulose sua matéria-prima, e uma das etapas de sua produção é o branqueamento, que visa remover a lignina da celulose. Diferentes processos de branqueamento usam, por exemplo, cloro (Cl2 ), hipoclorito de sódio (NaClO), oxigênio (O2 ), ozônio (O3 ) ou peróxido de hidrogênio (H2O2 ). Alguns processos de branqueamento levam à formação de compostos organoclorados. São apresentadas as estruturas de um fragmento da lignina e do tetracloroguaiacol, um dos organoclorados formados no processo de branqueamento.
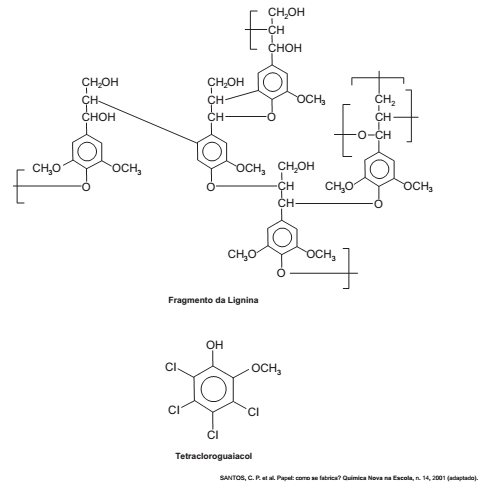
Os reagentes capazes de levar à formação de organoclorados no processo citado são
O2 e O3 .
Cl2 e O2 .
H2O2 e Cl2 .
NaClO e O3 .
NaClO e Cl2 .
O cobre presente nos fios elétricos e instrumentos musicais é obtido...
O cobre presente nos fios elétricos e instrumentos musicais é obtido a partir da ustulação do minério calcosita (Cu2S). Durante esse processo, ocorre o aquecimento desse sulfeto na presença de oxigênio, de forma que o cobre fique "livre" e o enxofre se combine com o O2 produzindo SO2 , conforme a equação química:
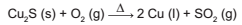
As massas molares dos elementos Cu e S são, respectivamente, iguais a 63,5 g/mol e 32 g/mol.
CANTO, E. L. Minerais, minérios, metais: de onde vêm?, para onde vão? São Paulo: Moderna, 1996 (adaptado).
Considerando que se queira obter 16 mols do metal em
uma reação cujo rendimento é de 80%, a massa, em
gramas, do minério necessária para obtenção do cobre
é igual a
955.
1 018.
1 590.
2 035.
3 180.
O urânio é um elemento cujos átomos contêm 92 prótons, 92...
O urânio é um elemento cujos átomos contêm 92 prótons, 92 elétrons e entre 135 e 148 nêutrons. O isótopo de urânio 235U é utilizado como combustível em usinas nucleares, onde, ao ser bombardeado por nêutrons, sofre fissão de seu núcleo e libera uma grande quantidade de energia (2,35 x1010 kJ/mol). O isótopo 235U ocorre naturalmente em minérios de urânio, com concentração de apenas 0,7%. Para ser utilizado na geração de energia nuclear, o minério é submetido a um processo de enriquecimento, visando aumentar a concentração do isótopo 235U para, aproximadamente, 3% nas pastilhas. Em décadas anteriores, houve um movimento mundial para aumentar a geração de energia nuclear buscando substituir, parcialmente, a geração de energia elétrica a partir da queima do carvão, o que diminui a emissão atmosférica de CO2 (gás com massa molar igual a 44 g/mol). A queima do carvão é representada pela equação química:
C(s) + O2 (g) → CO2(g) ΔH = -400 kJ/mol
Qual é a massa de CO2
, em toneladas, que deixa de ser
liberada na atmosfera, para cada 100 g de pastilhas de
urânio enriquecido utilizadas em substituição ao carvão
como fonte de energia?
2,10
7,70
9,00
33,0
300
