Calor Latente
O calor latente, também chamado de calor de transformação, é uma grandeza física que designa a quantidade de calor recebida ou cedida por um corpo enquanto seu estado físico se modifica.
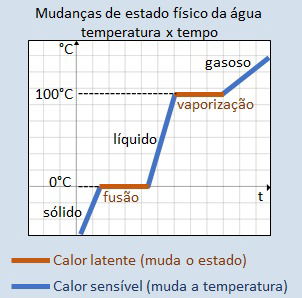
Importante destacar que durante a transformação a temperatura permanece a mesma, ou seja, constante.
Como exemplo, podemos pensar num cubo de gelo que está derretendo. Quando ele começa a mudar de estado físico (sólido para o líquido), a temperatura da água permanece a mesma nos dois estados.
Fórmula
Para calcular o calor latente é utilizada a fórmula:
Onde,
Q: quantidade de calor (cal ou J)
m: massa (g ou Kg)
L: calor latente (cal/g ou J/Kg)
No Sistema Internacional (SI), o calor latente é dado em J/Kg (Joule por quilograma). Mas também é usual ser medido em cal/g (caloria por grama).
Note que o calor latente pode apresentar valores negativos ou positivos. Sendo assim, se a substância estiver cedendo calor seu valor será negativo (processo exotérmico). Isso ocorre na solidificação e liquefação.
Por outro lado, se tiver recebendo calor, o valor será positivo (processo endotérmico). Isso ocorre na fusão e na vaporização.
Calor Latente de Vaporização
No calor latente ocorre a mudança de estado físico. Ou seja, a substância pode passar do estado sólido para o líquido, do líquido para o gasoso e vice-versa.
Quando a mudança é da fase líquida para a fase gasosa o calor latente é chamado calor de vaporização (Lv).
calor latente de vaporização da água é de 540 cal/g. Ou seja, são necessárias 540 cal para evaporar 1 g de água a 100 °C.
Nesse caso, a quantidade de calor necessária (Q) é proporcional à massa da substância (m):
onde,
Lv: é um valor constante que depende da substância.
Leia Estados Físicos da Água.
Calor Específico
O calor específico é a quantidade de calor necessária para aumentar a temperatura de 1 °C de 1g do elemento. Cada substância possui um calor específico, sendo uma propriedade do material.
Ele é calculado pela fórmula:
ou
Onde,
c: calor específico (cal/g°C ou J/Kg.K)
Q: quantidade de calor (cal ou J)
m: massa (g ou Kg)
Δθ: variação de temperatura (°C ou K)
C: capacidade térmica (cal/°C ou J/K)
Calor Sensível
O calor sensível provoca mudanças de temperatura. É uma grandeza diferente do calor latente, pois modifica a temperatura sem alterar estado da substância.
Um exemplo é quando aquecemos uma barra de metal. O resultado será observado pelo aumento da temperatura do material, no entanto, seu estado sólido não se altera.
Para calcular o calor sensível utiliza-se a seguinte fórmula:
Q: quantidade de calor sensível (cal ou J)
m: massa do corpo (g ou Kg)
c: calor específico da substância (cal/g°C ou J/Kg.°C)
Δθ: variação de temperatura (°C ou K)
Leia também Calorimetria.
Exercícios de Calor Latente
Exercício 1
(Unifor-CE) Um cubo de gelo de massa 100 g, inicialmente à temperatura de - 20 °C, é aquecido até se transformar em água a 40 °C (dados: calor específico do gelo 0,50 cal/g °C; calor específico da água 1,0 cal/g °C; calor de fusão do gelo 80 cal/g). As quantidades de calor sensível e de calor latente trocados nessa transformação, em calorias, foram, respectivamente:
a) 8.000 e 5.000
b) 5.000 e 8.000
c) 5.000 e 5.000
d) 4.000 e 8.000
e) 1.000 e 4.000
Exercício 2
(UNIP-SP) O calor específico latente de fusão do gelo é de 80 cal/g. Para fundir uma massa de gelo de 80g, sem variação de temperatura, a quantidade de calor latente necessária é de:
Exercício 3
(FUVEST) Dispõe-se de água a 80°C e gelo a 0°C. Deseja-se obter 100gramas de água a uma temperatura de 40°C (após o equilíbrio), misturando água e gelo em um recipiente isolante e com capacidade térmica desprezível. Sabe-se que o calor específico latente de fusão do gelo é 80 cal/g e o calor específico sensível da água é 1,0 cal/g°C. A massa de gelo a ser utilizada é:
a) 5,0g
b) 12,5g
c) 25g
d) 33g
e) 50g
Pratique mais com:
- Exercícios de calor específico resolvidos e explicados
- Exercício sobre calor sensível e calor latente (com gabarito).
ASTH, Rafael. Calor Latente. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/calor-latente/. Acesso em:


