Calorimetria
Calorimetria é a parte da física que estuda os fenômenos relacionados as trocas de energia térmica. Essa energia em trânsito é chamada de calor e ocorre devido a diferença de temperatura entre os corpos.
O termo calorimetria, é formada por duas palavras: “calor” e “metro”. Do latim, “calor” representa a qualidade do que é quente, e “metro”, do grego, significa medida.
Calor
O calor representa a energia transferida de um corpo para um outro, em função unicamente da diferença de temperatura entre eles.
Esse transporte de energia, na forma de calor, sempre ocorre do corpo de maior temperatura para o corpo de menor temperatura.

Estando os corpos isolados termicamente do exterior, essa transferência irá ocorrer até atingirem o equilíbrio térmico (temperaturas iguais).
Vale ainda ressaltar que um corpo não possui calor, ele possui energia interna. Portanto, só faz sentido falar em calor quando essa energia está sendo transmitida.
A transferência de energia, na forma de calor, quando produz no corpo uma mudança na sua temperatura é chamado de calor sensível. Quando gera uma mudança no seu estado físico é chamado de calor latente.
A grandeza que define essa energia térmica em trânsito é chamada de quantidade de calor (Q). No Sistema Internacional (SI), a unidade de quantidade de calor é o joule (J).
Contudo, na prática, usa-se também uma unidade chamada de caloria (cal). Essas unidades possuem a seguinte relação:
1 cal = 4,1868 J
Equação Fundamental da Calorimetria
A quantidade de calor sensível recebida ou cedida por um corpo pode ser calculada através da seguinte fórmula:
Q = m . c . ΔT
Sendo:
Q: quantidade de calor sensível (J ou cal)
m: massa do corpo (kg ou g)
c: calor específico (J/kg.ºC ou cal/g.ºC)
ΔT: variação de temperatura (ºC), ou seja, a temperatura final menos a temperatura inicial
Calor específico e capacidade térmica
O calor específico (c) é a constante de proporcionalidade da equação fundamental da calorimetria. Seu valor depende diretamente da substância que constitui o corpo, ou seja, do material o qual é feito.
Exemplo: o calor específico do ferro é igual a 0,11 cal/g.ºC, já o calor específico da água (líquida) é 1 cal/g.ºC.
Podemos ainda definir uma outra grandeza chamada capacidade térmica. Seu valor está relacionado ao corpo, levando em consideração a sua massa e a substância de que é feito.
Podemos calcular a capacidade térmica de um corpo, através da seguinte fórmula:
C = m.c
Sendo,
C: capacidade térmica (J/ºC ou cal/ºC)
m: massa (kg ou g)
c: calor específico (J/kg.ºC ou cal/g.ºC)
Exemplo
Em uma panela foram colocados 1,5 kg de água em temperatura ambiente (20 ºC). Ao ser aquecida, sua temperatura passa para 85 ºC. Considerando que o calor específico da água é de 1 cal/g ºC, calcule:
a) a quantidade de calor recebida pela água para atingir essa temperatura
b) a capacidade térmica dessa porção de água
Solução
a) Para encontrar o valor da quantidade de calor, devemos substituir todos os valores informados na equação fundamental da calorimetria.
Contudo, devemos ter uma atenção especial com as unidades. No caso, a massa de água foi informada em quilograma, como a unidade do calor específico está em cal/g ºC, iremos transformar essa unidade para grama.
m = 1,5 kg = 1500 g
ΔT = 85 - 20 = 65 ºC
c = 1 cal/g ºC
Q = 1500 . 1 . 65
Q = 97 500 cal = 97,5 kcal
b) O valor da capacidade térmica é encontrado substituindo os valores da massa da água e o seu calor específico. Mais uma vez, iremos usar o valor da massa em gramas.
C = 1. 1500 = 1500 cal/ ºC
Mudança de Estado
Podemos ainda calcular a quantidade de calor recebida ou cedida por um corpo que gerou uma mudança em seu estado físico.
Para tal, devemos assinalar que durante o período em que um corpo está mudando de fase, sua temperatura é constante.
Assim, o cálculo da quantidade de calor latente é feito usando-se a seguinte fórmula:
Q = m.L
Sendo:
Q: quantidade de calor (J ou cal)
m: massa (kg ou g)
L: calor latente (J/kg ou cal/g)
Exemplo
Qual a quantidade de calor necessária para que um bloco de 600 kg de gelo, a 0 ºC, se transforme em água nessa mesma temperatura. Considere que o calor latente de fusão do gelo é de 80 cal/g.
Solução
Para calcular a quantidade de calor latente, substitui-se os valores dados na fórmula. Não esquecendo de transformar as unidades, quando necessário:
m = 600 kg = 600 000 g
L = 80 cal/g ºC
Q = 600 000 . 80 = 48 000 000 cal = 48 000 kcal
Trocas de Calor
Quando dois ou mais corpos trocam calor entre si, essa transferência de calor acontecerá de forma que o corpo com maior temperatura cederá calor para o de menor temperatura.
Em sistemas isolados termicamente, essas trocas de calor irão ocorrer até que seja estabelecido o equilíbrio térmico do sistema. Nesta situação, a temperatura final será a mesma para todos os corpos envolvidos.
Assim, a quantidade de calor cedida será igual a quantidade de calor absorvida. Em outras palavras, a energia total do sistema se conserva.
Este fato pode ser representado através da seguinte fórmula:
Sendo:
ΣQ: soma total da quantidade de calor do sistema
Q1,Q2,...,Qn: quantidade de calor cedida ou recebida por cada corpo, sendo que o calor recebido é positivo e o calor cedido é negativo.
Fluxo de Calor
A transferência de calor entre dois ou mais corpos ocorre ao longo do tempo. Desta maneira, podemos calcular esse fluxo de calor usando a seguinte fórmula:
Sendo,
ϕ: fluxo de calor. A unidade do fluxo de calor no SI é o J/s que é chamado de watt (W). Pode-se usar ainda o cal/s.
Q: quantidade de calor (J ou cal).
Δt: intervalo de tempo (s)
Propagação do Calor
A propagação de calor entre os corpos ocorre de três maneiras: condução, convecção e irradiação.
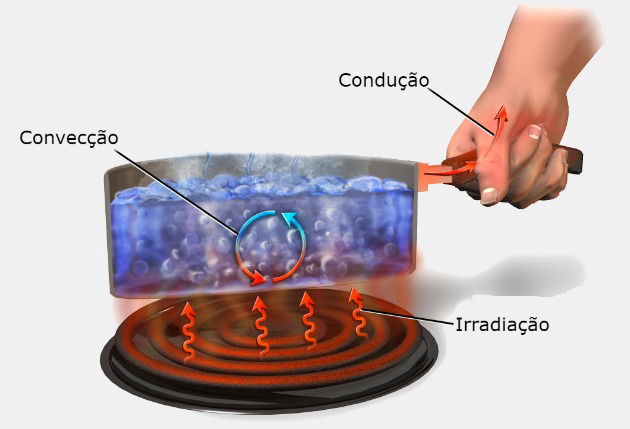
Condução
Na condução térmica, a propagação do calor ocorre através da agitação térmica dos átomos e molécula. Essa agitação é transmitida ao longo do corpo, enquanto existir diferença de temperatura entre as suas diferentes partes.
É importante notar que essa transmissão de calor necessita de um meio material para ocorrer. Ela é mais efetiva nos sólidos do que nos corpos fluidos.
Existem substâncias que permitem essa transmissão com maior facilidade, são os condutores de calor. Os metais, de uma maneira geral, são bons condutores de calor.
Por outro lado, há materiais que conduzem mal o calor, e são chamados de isolantes térmicos, é o caso, por exemplo, do isopor, da cortiça e da madeira.
Um exemplo dessa transferência de calor por condução acontece ao mexermos uma panela no fogo com uma colher de alumínio.
Nesta situação, rapidamente a colher esquenta queimando nossa mão. Por isso, é muito comum usarmos colheres de madeira para evitar esse aquecimento rápido.
Convecção
Na convecção térmica, a transferência de calor acontece por transporte do material aquecido, em função da diferença de densidade. A convecção acontece nos líquidos e nos gases.
Quando uma parte da substância é aquecida, a densidade dessa parte diminui. Essa mudança na densidade cria um movimento no interior do líquido ou do gás.
A parte aquecida irá subir e a porção mais densa irá descer, criando o que chamamos de correntes de convecção.
Isso explica o aquecimento da água numa panela, que acontece por meio das correntes da convecção, onde a água que está mais próxima do lume, sobe, enquanto a que está fria, desce.
Irradiação
A Irradiação térmica corresponde a transferência de calor por meio de ondas eletromagnéticas. Este tipo de transmissão de calor ocorre sem a necessidade de existir um meio material entre os corpos.
Desta forma, a irradiação pode ocorrer sem que os corpos estejam em contato, por exemplo, a irradiação solar que incide no planeta Terra.
Ao atingir um corpo, parte da radiação é absorvida e parte é refletida. A quantidade que é absorvida aumenta a energia cinética das moléculas do corpo (energia térmica).
Os corpos escuros absorvem a maior parte da radiação que incide sobre eles, ao passo que os corpos claros refletem a maior parte da radiação.
Desta maneira, corpos escuros ao serem colocados ao Sol aumentam muito mais rapidamente sua temperatura do que os corpos de cor clara.
Continue sua pesquisa!
- Escalas Termométricas
- Calor e Temperatura
- Termodinâmica
- Dilatação Térmica
- Dilatação Linear
- Dilatação Superficial
- Dilatação Volumétrica
- Fórmulas de Física
Exercício Resolvido
1) Enem - 2016
Num experimento, um professor deixa duas bandejas de mesma massa, uma de plástico e outra de alumínio, sobre a mesa do laboratório. Após algumas horas, ele pede aos alunos que avaliem a temperatura das duas bandejas, usando para isso o tato. Seus alunos afirmam, categoricamente, que a bandeja de alumínio encontra-se numa temperatura mais baixa. Intrigado, ele propõe uma segunda atividade, em que coloca um cubo de gelo sobre cada uma das bandejas, que estão em equilíbrio térmico com o ambiente, e os questiona em qual delas a taxa de derretimento do gelo será maior.
O aluno que responder corretamente ao questionamento do professor dirá que o derretimento ocorrerá
a) mais rapidamente na bandeja de alumínio, pois ela tem uma maior condutividade térmica que a de plástico.
b) mais rapidamente na bandeja de plástico, pois ela tem inicialmente uma temperatura mais alta que a de alumínio.
c) mais rapidamente na bandeja de plástico, pois ela tem uma maior capacidade térmica que a de alumínio.
d) mais rapidamente na bandeja de alumínio, pois ela tem um calor específico menor que do plástico.
e) com a mesma rapidez nas duas bandejas, pois apresentarão a mesma variação de temperatura.
2) Enem - 2013
Em um experimento foram utilizadas duas garrafas PET, uma pintada de branco e a outra de preto, acopladas cada uma a um termômetro. No ponto médio da distância entre as garrafas, foi mantida acesa, durante alguns minutos, uma lâmpada incandescente. Em seguida a lâmpada foi desligada. Durante o experimento, foram monitoradas as temperaturas das garrafas: a) enquanto a lâmpada permaneceu acesa e b) após a lâmpada ser desligada e atingirem equilíbrio térmico com o ambiente.
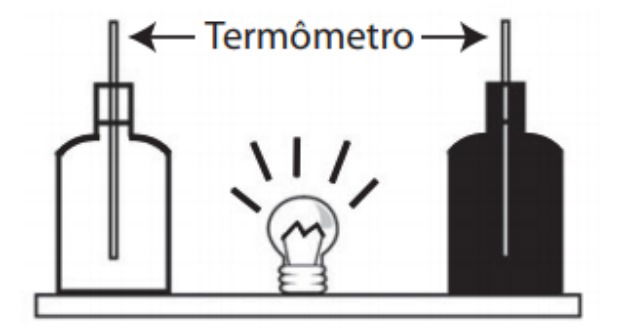
A taxa de variação da temperatura da garrafa preta, em comparação à da branca, durante todo experimento, foi
a) igual no aquecimento e igual no resfriamento.
b) maior no aquecimento e igual no resfriamento.
c) menor no aquecimento e igual no resfriamento.
d) maior no aquecimento e menor no resfriamento.
e) maior no aquecimento e maior no resfriamento.
3) Enem - 2013
Aquecedores solares usados em residências têm o objetivo de elevar a temperatura da água até 70 °C. No entanto, a temperatura ideal da água para um banho é de 30 °C. Por isso, deve-se misturar a água aquecida com a água à temperatura ambiente de um outro reservatório, que se encontra a 25 °C.
Qual a razão entre a massa de água quente e a massa de água fria na mistura para um banho à temperatura ideal?
a) 0,111.
b) 0,125.
c) 0,357.
d) 0,428.
e) 0,833
Aprenda mais com exercícios de calor específico resolvidos e explicados.
GOUVEIA, Rosimar. Calorimetria. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/calorimetria/. Acesso em:


