Termodinâmica
A termodinâmica é uma área da Física que estuda as transferências de energia. Busca compreender as relações entre calor, energia e trabalho, analisando quantidades de calor trocadas e os trabalhos realizados em um processo físico.
A ciência termodinâmica foi inicialmente desenvolvida por pesquisadores que buscavam uma forma de aprimorar as máquinas, no período da Revolução Industrial, melhorando sua eficiência.
Esses conhecimentos se aplicam atualmente em várias situações do nosso cotidiano. Por exemplo, máquinas térmicas e refrigeradores, motores de carros e processos de transformação de minérios e derivados do petróleo
Leis da Termodinâmica
As leis fundamentais da termodinâmica regem o modo como o calor se transforma em trabalho e vice-versa.
Primeira Lei da Termodinâmica
A Primeira Lei da Termodinâmica se relaciona com o princípio da conservação da energia. Isso quer dizer que a energia em um sistema não pode ser destruída nem criada, somente transformada.
A fórmula que representa a primeira lei da termodinâmica é a seguinte:

Alguns autores utilizam a letra W para designar trabalho, assim como, expressar a fórmula assim:
A quantidade de calor, o trabalho e a variação de energia interna possuem como unidade de medida padrão o Joule (J).
Um exemplo prático da conservação de energia ocorre quando uma pessoa usa uma bomba para encher um objeto inflável, ela está usando força para colocar ar dentro do objeto. Isso significa que a energia cinética é usada para mover o pistão da bomba para baixo.
A Lei de Hess é um caso particular do princípio da conservação de energia. Saiba mais!
Segunda Lei da Termodinâmica
As transferências de calor ocorrem sempre do corpo mais quente para o corpo mais frio, isso acontece de forma espontânea, mas o contrário não. O que significa dizer que os processos de transferência de energia térmica são irreversíveis.
Desse modo, pela Segunda Lei da Termodinâmica, não é possível que o calor se converta integralmente em outra forma de energia. Por esse motivo, o calor é considerado uma forma degradada de energia.
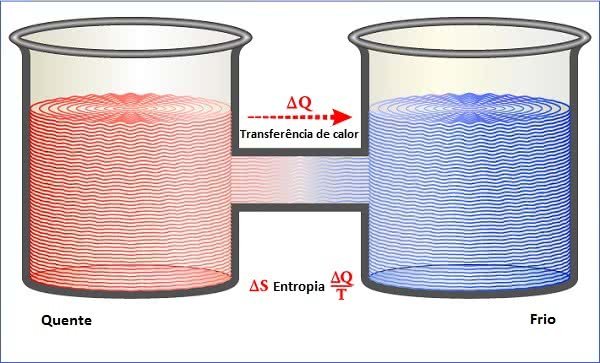
A grandeza física relacionada com a Segunda Lei da Termodinâmica é a entropia, que corresponde ao grau de desordem de um sistema.
Leia também:
Lei Zero da Termodinâmica
A Lei Zero da Termodinâmica trata das condições para a obtenção do equilíbrio térmico. Dentre essas condições podemos citar a influência dos materiais que tornam a condutividade térmica maior ou menor.
Segundo essa lei,
- se um corpo A está em equilíbrio térmico em contato com um corpo B e
- se esse corpo A está em equilíbrio térmico em contato com um corpo C, logo
- B está em equilíbrio térmico em contato com C.
Quando dois corpos com temperaturas diferentes são colocados em contato, aquele que estiver mais quente irá transferir calor para aquele que estiver mais frio. Isso faz com que as temperaturas se igualem chegando ao equilíbrio térmico.
É chamada de lei zero porque o seu entendimento mostrou-se necessário para as primeiras duas leis que já existiam, a primeira e a segunda leis da termodinâmica.
Terceira Lei da Termodinâmica
A Terceira Lei da Termodinâmica surge como uma tentativa de estabelecer um ponto de referência absoluto que determine a entropia. A entropia é, na verdade, a base da Segunda Lei da Termodinâmica.
Walther Nernst, o físico que a propôs, concluiu que não era possível que uma substância pura com temperatura zero apresentasse a entropia num valor aproximado a zero.
Por esse motivo, trata-se de uma lei polêmica, considerada por muitos físicos como uma regra e não uma lei.
Sistemas termodinâmicos
Em um sistema termodinâmico pode haver um ou vários corpos que se relacionam. O meio que o envolve e o Universo representam o meio externo ao sistema. O sistema pode ser definido como: aberto, fechado ou isolado.
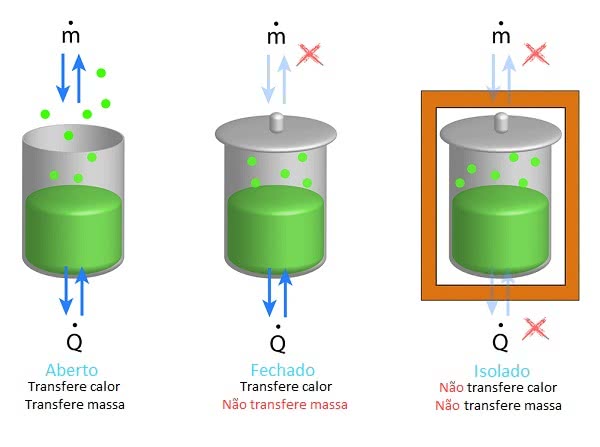 Sistemas termodinâmicos
Sistemas termodinâmicos
Quando o sistema é aberto, há transferência de massa e energia entre o sistema e o meio externo. No sistema fechado há apenas transferência de energia (calor), e quando é isolado não há trocas.
Comportamento dos gases
O comportamento microscópico dos gases é descrito e interpretado de forma mais fácil do que nos outros estados físicos (líquido e sólido). É por isso que os gases são mais usados nesses estudos.
Nos estudos termodinâmicos são usados gases ideais ou perfeitos. É um modelo no qual as partículas se movem de forma caótica e interagem apenas nas colisões. Além disso, se considera que essas colisões entre as partículas, e delas com as paredes do recipientes, são elásticas e duram por pouquíssimo tempo.
Em um sistema fechado, o gás ideal pressupõe um comportamento que envolve as seguintes grandezas físicas: pressão, volume e temperatura. Essas variáveis definem o estado termodinâmico de um gás.
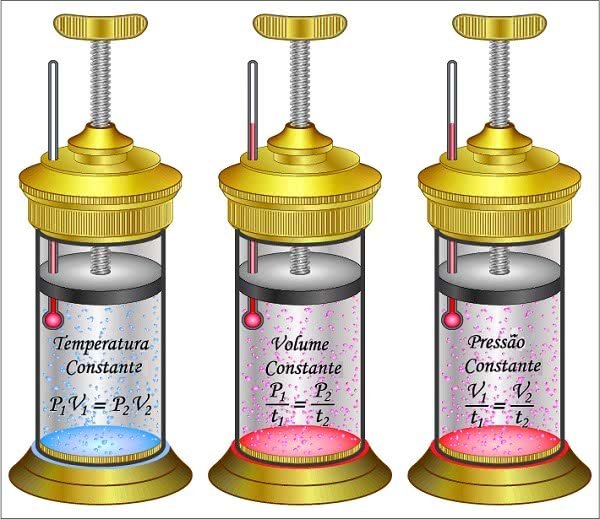 Comportamento dos gases segundo as leis dos gases
Comportamento dos gases segundo as leis dos gases
A pressão (p) é produzida pelo movimento das partículas do gás dentro do recipiente. O espaço ocupado pelo gás no interior do recipiente é o volume (v). E a temperatura (t) está relacionada com a energia cinética média das partículas do gás em movimento.
Leia também Lei dos Gases e Estudo dos Gases.
Energia interna
A energia interna de um sistema é uma grandeza física que ajuda a medir como ocorrem as transformações pelas quais um gás passa. Essa grandeza está relacionada com a variação da temperatura e da energia cinética das partículas.
Um gás ideal, formado por apenas um tipo de átomo, possui energia interna diretamente proporcional à temperatura do gás. Isso é representado pela fórmula a seguir:
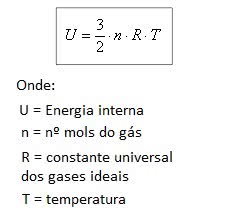
Onde, R = 8,31 J/mol K.
Exercícios resolvidos sobre Termodinâmica
Questão 1
Um cilindro com êmbolo móvel contém um gás à pressão de 4,0.104N/m2. Quando é fornecido 6 kJ de calor ao sistema, à pressão constante, o volume do gás sofre expansão de 1,0.10-1m3. Determine o trabalho realizado e a variação da energia interna nessa situação.
Questão 2
(Adaptado do ENEM 2011) Um motor só poderá realizar trabalho se receber uma quantidade de energia de outro sistema. No caso, a energia armazenada no combustível é, em parte, liberada durante a combustão para que o aparelho possa funcionar. Quando o motor funciona, parte da energia convertida ou transformada na combustão não pode ser utilizada para a realização de trabalho. Isso quer dizer que há vazamento da energia em outra forma.
De acordo com o texto, as transformações de energia que ocorrem durante o funcionamento do motor são decorrentes da:
a) liberação de calor dentro do motor ser impossível.
b) realização de trabalho pelo motor ser incontrolável.
c) conversão integral de calor em trabalho ser impossível.
d) transformação de energia térmica em cinética ser impossível.
e) utilização de energia potencial do combustível ser incontrolável.
Veja também:
- Exercícios sobre Termodinâmica
- Exercícios da primeira lei da termodinâmica
- Exercícios de gases perfeitos
- Calor Específico
- Lei de Fourier: o que é e fórmulas (aprenda a calcular)
BATISTA, Carolina. Termodinâmica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/termodinamica/. Acesso em:



