Lei de Hess
A Lei de Hess permite calcular a variação da entalpia, que é a quantidade de energia presente nas substâncias após sofrerem reações químicas. Isso porque não é possível medir a entalpia em si, mas sim a sua variação.
A Lei de Hess fundamenta o estudo da Termoquímica.
Essa Lei foi experimentalmente desenvolvida por Germain Henry Hess, o qual estabeleceu:
A variação de entalpia (ΔH) em uma reação química depende apenas dos estados inicial e final da reação, independente do número de reações.
Como a Lei de Hess pode ser calculada?
A variação da entalpia pode ser calculada subtraindo a entalpia inicial (antes da reação) da entalpia final (depois da reação):
ΔH = Hf – Hi
Outra forma de calcular é através da soma das entalpias em cada uma das reações intermediárias. Independente do número e tipo das reações.
ΔH = ΔH1 + ΔH2
Uma vez que esse cálculo considera apenas os valores inicial e final, conclui-se que a energia intermédia não influencia no resultado da sua variação.
Trata-se de um caso particular do Princípio da Conservação de Energia, a Primeira Lei da Termodinâmica.
Você também deve saber que a Lei de Hess pode ser calculada como uma equação matemática. Para isso, é possível realizar as seguintes ações:
- Inverter a reação química, nesse caso o sinal do ΔH também deve ser invertido;
- Multiplicar a equação, o valor do ΔH também deve ser multiplicado;
- Dividir a equação, o valor do ΔH também deve ser dividido.
Saiba mais sobre Entalpia.
Diagrama de entalpia
A Lei de Hess também pode ser visualizada através de diagramas de energia:
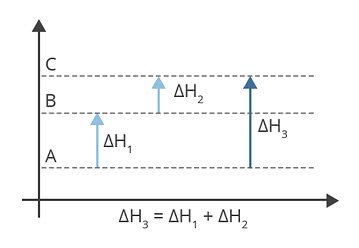
O diagrama acima mostra os níveis de entalpia. Nesse caso, as reações sofridas são endotérmicas, ou seja, há absorção de energia.
ΔH1 é a variação de entalpia que acontece de A para B. Suponhamos que ela seja 122 kj.
ΔH2 é a variação de entalpia que acontece de B para C. Suponhamos que ela seja 224 kj.
ΔH3 é a variação de entalpia que acontece de A para C.
Assim, nos importa saber o valor de ΔH3, pois corresponde à variação de entalpia da reação de A para C.
Podemos descobrir o valor de ΔH3, a partir da soma da entalpia em cada uma das reações:
ΔH3 = ΔH1 + ΔH2
ΔH3 = 122 kj + 224 kj
ΔH3 = 346 kj
Ou ΔH = Hf – Hi
ΔH = 346 kj – 122 kj
ΔH = 224 kj
Exercício de vestibular: Resolvido passo a passo
1. (Fuvest-SP) Com base nas variações de entalpia associadas às reações a seguir:
N2(g) + 2 O2(g) → 2 NO2(g) ∆H1 = +67,6 kJ
N2(g) + 2 O2(g) → N2O4(g) ∆H2 = +9,6 kJ
Pode-se prever que a variação de entalpia associada à reação de dimerização do NO2 será igual a:
2 NO2(g) → 1 N2O4(g)
a) –58,0 kJ b) +58,0 kJ c) –77,2 kJ d) +77,2 kJ e) +648 kJ
Resolução:
Passo 1: Inverter a primeira equação. Isso porque o NO2(g) precisa passar para o lado dos reagentes, conforme a equação global. Lembre-se que ao inverter a reação o ∆H1 também inverte o sinal, passando para negativo.
A segunda equação é conservada.
2 NO2(g) → N2(g) + 2 O2(g) ∆H1 = - 67,6 kJ
N2(g) + 2 O2(g) → N2O4(g) ∆H2 = +9,6 kJ
Passo 2: Observe que N2(g) aparece nos produtos e reagentes e o mesmo acontece com 2 mol de O2(g).
2 NO2(g) → N2(g)+ 2 O2(g)∆H1 = - 67,6 kJ
N2(g) + 2 O2(g) → N2O4(g) ∆H2 = +9,6 kJ
Assim, eles podem ser cancelados resultando na seguinte equação:
2 NO2(g) → N2O4(g).
Passo 3: Você pode observar que chegamos a equação global. Agora devemos somar as equações.
∆H = ∆H1 + ∆H2
∆H = - 67,6 kJ + 9,6 kJ
∆H = - 58 kJ ⇒ Alternativa A
Pelo valor negativo de ∆H também sabemos que trata-se de uma reação exotérmica, com liberação de calor.
Saiba mais, leia também:
- Termoquímica
- Exercícios sobre Termoquímica
- Reações Endotérmicas e Exotérmicas
- Segunda Lei da Termodinâmica
Exercícios
1. (UDESC-2012) O gás metano pode ser utilizado como combustível, como mostra a equação 1:
CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
Utilizando as equações termoquímicas abaixo, que julga necessário, e os conceitos da Lei de Hess, obtenha o valor de entalpia da equação 1.
C(s) + H2O(g) → CO(g) + H2(g) ΔH = 131,3 kJ mol-1
CO(g) + ½ O2(g) → CO2(g) ΔH = – 283,0 kJ mol-1
H2(g) + ½ O2(g) → H2O(g) ΔH = – 241,8 kJ mol-1
C(s) + 2H2(g) → CH4(g) ΔH = – 74,8 kJ mol-1
O valor da entalpia da equação 1, em kJ, é:
a) - 704,6
b) - 725,4
c) - 802,3
d) - 524,8
e) - 110,5
2. (UNEMAT-2009) A Lei de Hess tem importância fundamental no estudo da Termoquímica e pode ser enunciada como “a variação da entalpia em uma reação química depende apenas dos estados inicial e final da reação”. Uma das consequências da Lei de Hess é que as equações termoquímicas podem ter tratamento algébrico.
Dadas as equações:
C (grafite) + O2(g) → CO2(g) ΔH1 = -393,3 kj
C (diamante) + O2(g) → CO2(g) ΔH2 = -395,2 kj
Com base nas informações acima, calcule a variação de entalpia da transformação do carbono grafite em carbono diamante e assinale a alternativa correta.
a) -788,5 kj
b) +1,9 kj
c) +788,5 kj
d) -1,9 kj
e) +98,1 kj
MAGALHÃES, Lana. Lei de Hess. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/lei-de-hess/. Acesso em:



