Cinética Química
A cinética química estuda a velocidade das reações químicas e os fatores que alteram esta velocidade.
Reações químicas são o resultado de ações entre substâncias que geralmente formam outras substâncias.
Velocidade das Reações Químicas
O que determina a rapidez com que ocorre uma reação química é o tempo em que os reagentes são consumidos para formar produtos. Assim, a velocidade de uma reação pode ser representada tanto pelo consumo de um reagente, quanto pela geração de um produto.
Antes de acontecer a reação química, temos quantidade máxima de reagentes e nenhum produto. Quando um dos reagentes é totalmente consumido, formam-se os produtos e a reação termina.
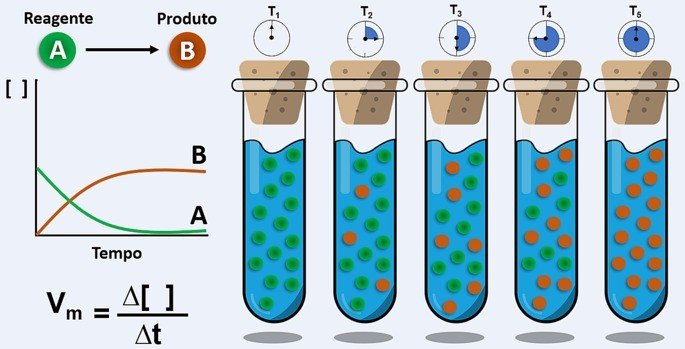
A Velocidade Média de uma reação química é a variação na quantidade de um reagente ou produto em um determinado intervalo de tempo.
Quando calculamos a velocidade média, queremos saber a velocidade em que um reagente foi consumido ou a velocidade em que um produto foi formado.
As unidades utilizadas no cálculo para expressar as substâncias produzidas ou consumidas podem ser, por exemplo, concentração, em mol/L, quantidade de matéria, em mol, e variação da pressão para gases, em atm. Já a variação do tempo pode ser dada em segundos (s), minutos (min) ou horas (h).
Exemplo: uma reação química genérica pode ser representada pela equação:
Onde,
A e B são os reagentes
C e D são os produtos
a, b, c e d são os coeficientes da equação balanceada
Portanto, a velocidade de consumo dos reagentes e de formação dos produtos podem ser expressas da seguinte forma:
| Consumo | Formação |
|---|---|
Note que o símbolo [ ] refere-se à concentração, geralmente apresentada em mol/L.
A taxa de desenvolvimento média de uma reação química leva em consideração, além do consumo ou formação dos produtos, os coeficientes da equação balanceada.
Observe que os valores negativos indicam o consumo da substância e os valores positivos indicam que as substâncias estão surgindo.
As reações químicas diferem na velocidade em que acontecem. Elas podem ser rápidas, moderadas ou lentas:
- Reações rápidas ocorrem instantaneamente, com duração de microssegundos. Um exemplo é a queima do gás de cozinha.
- Reações moderadas levam de minutos a horas para serem finalizadas. Um exemplo é a queima do papel.
- Reações lentas podem durar séculos, porque os reagentes combinam-se lentamente. Um exemplo é a formação do petróleo.
Teoria das Colisões
A teoria das colisões é aplicada para reações gasosas. Ela determina que para a reação química acontecer os reagentes devem estar em contato, através de colisões.
Entretanto, apenas isso não garante que a reação ocorra. Também é preciso que as colisões sejam efetivas (orientadas). Isso garantirá que as moléculas adquiram energia suficiente, a energia de ativação.
Energia de ativação
A energia de ativação (Ea) é a energia mínima necessária para que a formação do complexo ativado e, portanto, efetiva realização da reação.
O complexo ativado é um estado transitório da reação, entre os reagentes, enquanto os produtos finais ainda não foram formados.

As reações mais rápidas são aquelas que apresentam a menor energia de ativação. Um exemplo de energia de ativação no nosso dia a dia é a energia obtida pelo atrito para acender um fósforo.
Fatores que Influenciam na Velocidade das Reações
Os principais fatores que afetam a velocidade das reações são:
Concentração de Reagentes
Quando a concentração dos reagentes aumenta, a frequência de choques entre as moléculas também aumenta, acelerando a reação. Quanto maior a concentração dos reagentes, maior a velocidade da reação.
Superfície de Contato
Essa condição afeta apenas reações entre sólidos. A superfície de contato é a área de um reagente que fica exposta aos demais reagentes. Como as reações precisam de contato entre os reagentes, concluímos que: quanto maior a superfície de contato, maior a velocidade da reação.
Pressão
Essa condição afeta apenas reações com gases. Com o aumento da pressão, o espaço entre as moléculas diminui, fazendo com que tenham mais colisões, aumentando a velocidade da reação. Quanto maior a pressão, maior a velocidade da reação.
Temperatura
Temperatura é uma medida de energia cinética, que corresponde ao grau de agitação das partículas. Quando a temperatura é alta, as moléculas estão mais agitadas, aumentando a velocidade da reação. Quanto maior a temperatura, maior a velocidade da reação.
Catalisadores
O catalisador é uma substância capaz de acelerar uma reação química, sem ser consumido ao final da reação. As enzimas são catalisadores biológicos. A presença de um catalisador aumenta a velocidade da reação.
Exercícios sobre cinética química
Questão 1
(Cesgranrio) Com relação a um fogão de cozinha, que utiliza mistura de hidrocarbonetos gasosos como combustível, é correto afirmar que:
a) a chama se mantém acesa, pois o valor da energia de ativação para ocorrência da combustão é maior que o valor relativo ao calor liberado.
b) a reação de combustão do gás é um processo endotérmico.
c) a entalpia dos produtos é maior que a entalpia dos reagentes na combustão dos gases.
d) a energia das ligações quebradas na combustão é maior que a energia das ligações formadas.
e) se utiliza um fósforo para acender o fogo, pois sua chama fornece energia de ativação para a ocorrência da combustão.
Questão 2
(CEFET-PR-2003) A velocidade de uma reação pode ser medida verificando-se experimentalmente quanto de reagentes (ou produtos) são consumidos (ou gerados) num determinado intervalo de tempo. Dependendo das condições experimentais, a velocidade pode ser extremamente lenta ou rápida.
Reações rápidas devem ser controladas, para que ocorram sob condições tais que possam trazer algum benefício prático. Já as reações muito lentas devem ser aceleradas para que a produção de uma determinada substância seja economicamente viável. Para que sejam alcançadas estas condições é necessário compreender algumas condições que influenciam a velocidade de uma reação.
A alternativa que NÃO representa um fator que altera a velocidade de uma reação é:
a) concentração dos reagentes.
b) número de colisões efetivas.
c) superfície de contato.
d) temperatura.
e) variação de entalpia da reação.
Questão 3
Observe a seguir uma reação hipotética de decomposição.
A variação de concentração do reagente em função do tempo está representada na tabela a seguir:
| [A] em mol/L | 0,244 | 0,200 | 0,180 | 0,175 | 0,162 |
|---|---|---|---|---|---|
| Tempo em min | 0 | 3 | 5 | 9 | 12 |
Com base nos dados, qual a velocidade média de decomposição entre 3 e 5 minutos?
a) 0,01 mol/L.min
b) 0,02 mol/L.min
c) 0,12 mol/L.min
d) 0,10 mol/L.min
Questão 4
(Unesp) Sobre catalisadores, são feitas as quatro afirmações seguintes.
I - São substâncias que aumentam a velocidade de uma reação.
II - Reduzem a energia de ativação da reação.
III - As reações nas quais atuam não ocorreriam nas suas ausências.
IV - Enzimas são catalisadores biológicos.
Dentre estas afirmações, estão corretas, apenas:
a) I e II.
b) II e III.
c) I, II e III.
d) I, II e IV.
e) II, III e IV.
Adquira mais conhecimento lendo os textos a seguir:
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005.
BATISTA, Carolina. Cinética Química. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/cinetica-quimica/. Acesso em:




