Solubilidade
Solubilidade é a propriedade física das substâncias de se dissolverem, ou não, em um determinado líquido.
Denomina-se soluto, os compostos químicos que se dissolvem em outra substância. O solvente é a substância na qual o soluto será dissolvido para formação de um novo produto.
A dissolução química é o processo de dispersão do soluto em um solvente, dando a origem a uma solução ou mistura homogênea.
Os solutos podem ser classificados em:
- Solúvel: são os solutos que se dissolvem no solvente.
- Pouco solúvel: são os solutos que apresentam dificuldade de se dissolver no solvente.
- Insolúvel: são os solutos que não se dissolvem no solvente.
Um princípio comum em solubilidade é: “semelhante dissolve semelhante”. Isso quer dizer que um soluto polar tende a se dissolver em um solvente polar. O mesmo é verdadeiro para substâncias apolares.
Veja alguns exemplos:
- Os hidrocarbonetos, compostos presentes na gasolina, são apolares e apresentam pouca solubilidade em água, que é polar.
- Os álcoois, como o etanol e o metanol, são polares devido à presença do oxigênio na cadeia carbônica e, por isso, são solúveis em água.
- Os sais apresentam solubilidade diferenciada. Eles podem ser classificados em: sal solúvel e sal praticamente insolúvel.
Coeficiente de Solubilidade
O coeficiente de solubilidade (Cs) determina a capacidade máxima do soluto que se dissolve em uma determinada quantidade de solvente. Isso, conforme as condições de temperatura.
Em resumo, o coeficiente de solubilidade é a quantidade de soluto necessária para saturar uma quantidade padrão de solvente a uma determinada condição.
Por exemplo, considere a seguinte situação:
Em um copo de água com sal (NaCl), inicialmente, o sal desaparece na água.
Entretanto, se for adicionado mais sal, em determinado momento ele começará a se acumular no fundo do copo.
Isso acontece porque a água, que é o solvente, atingiu o seu limite de solubilidade e a quantidade máxima de concentração. A isso também chamamos de ponto de saturação.
O soluto que resta no fundo do recipiente e que não se dissolve é chamado de corpo de fundo ou precipitado.
Em relação ao ponto de saturação, as soluções classificam-se em três tipos:
- Solução insaturada: quando a quantidade de soluto é menor que Cs.
- Solução saturada: quando a quantidade de soluto é exatamente a mesma do Cs. É o limite de saturação.
- Solução supersaturada: quando a quantidade do soluto é maior que o Cs.
Produto de Solubilidade
Como vimos, a solubilidade representa a quantidade de soluto dissolvida em uma solução. O produto de solubilidade (Kps) é uma constante de equilíbrio diretamente relacionada com a solubilidade.
O seu cálculo permite determinar se uma solução é saturada, insaturada ou saturada com precipitado. Esse cálculo está relacionado com o equilíbrio de dissolução e a concentração de íons na solução.
Isso porque o produto da solubilidade refere-se ao equilíbrio de dissolução de substâncias iônicas.
Entenda mais sobre Soluto e Solvente.
Curva de Solubilidade
A capacidade de solubilidade química de uma substância submetida à alteração de temperatura não é linear. A variação da capacidade de solubilidade, em função da temperatura, é conhecida por curva de solubilidade.
A maioria das substâncias sólidas têm o seu coeficiente de solubilidade aumentado com o aumento da temperatura. Assim, a solubilidade de cada material ocorre de maneira proporcional, conforme a temperatura.
Cada substância possui uma curva de solubilidade própria para um determinado solvente.
A variação de solubilidade é considerada linear quando não está sob influência da temperatura. Para conhecer a variação é preciso observar a curva de solubilidade.
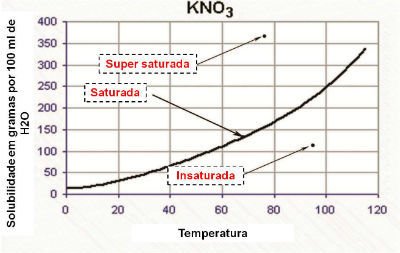
Curva de Solubilidade
No gráfico, a curva de solubilidade demonstra que a solução é:
- Saturada: quando o ponto está sobre a curva de solubilidade.
- Insaturada: quando o ponto está abaixo da curva de solubilidade.
- Saturada homogênea: quando o ponto está acima da curva de solubilidade.
Leia também sobre Concentração de Soluções.
Fórmula do Coeficiente de Solubilidade
A fórmula para calcular o coeficiente de solubilidade é:
Cs = 100 . m1/m2
onde:
Cs:coeficiente de solubilidade
m1: massa do soluto
m2: massa do solvente
Quer saber mais? Leia Soluções Químicas e Diluição de Soluções.
Exercícios
1. (Fuvest-SP) Um químico leu a seguinte instrução num procedimento descrito no seu guia de laboratório:
"Dissolva 5,0 g de Cloreto em 100 mL de água, à temperatura ambiente..." .
Dentre as substâncias abaixo, qual é a citada no texto?
a) Cl2.
b) CCl4.
c) NaClO.
d) NH4Cl.
e) AgCl.
2. (UFRGS-RS) Um determinado sal apresenta solubilidade em água igual a 135g/L, a 25°C. Dissolvendo-se, completamente, 150 g desse sal em um litro de água, a 40°C, e resfriando-se lentamente o sistema até 25°C, obtém-se um sistema homogêneo cuja solução será:
a) diluída.
b) concentrada.
c) insaturada.
d) saturada.
e) supersaturada.
3. (Mackenzie-SP) Um exemplo típico de solução supersaturada é:
a) água mineral.
b) soro caseiro.
c) refrigerante em recipiente fechado.
d) álcool 46° GL.
e) vinagre.
4. (PUC-RJ) Observe a figura abaixo, que representa a solubilidade, em g por 100 g de H2O, de 3 sais inorgânicos numa determinada faixa de temperatura:
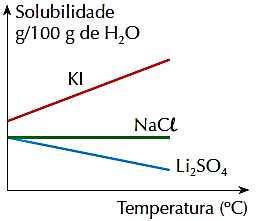
Assinale a afirmação correta:
a) A solubilidade dos 3 sais aumenta com a temperatura.
b) O aumento de temperatura favorece a solubilização do Li2SO4.
c) A solubilidade do KI é maior que as solubilidades dos demais sais, na faixa de temperatura representada.
d) A solubilidade do NaCl varia com a temperatura.
e) A solubilidade de 2 sais diminui com a temperatura.
Confira questões com resolução comentada em exercícos sobre soluções.
MAGALHÃES, Lana. Solubilidade. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/solubilidade/. Acesso em:


