Raio Atômico
O raio atômico dos elementos é uma propriedade periódica que determina o raio de um átomo, que varia dependendo da posição do elemento na Tabela Periódica.
Assim, eles podem aumentar ou diminuir conforme o número atômico (Z), que corresponde ao número de prótons presentes no núcleo dos átomos.
O raio atômico corresponde à metade da distância entre os núcleos de dois átomos vizinhos, expresso como:
Onde:
r é o raio,
d é a distância entre os núcleos de dois átomos vizinhos, do mesmo elemento.
Geralmente o raio atômico é medido em picômetros (pm), submúltiplo do metro (1 picômetro = ). Note que quando a referência não é um átomo, mas um íon, o raio encontrado é o raio iônico.
Variação do Raio Atômico
Na tabela periódica o crescimento do raio atômico pode ser observado na figura a seguir:
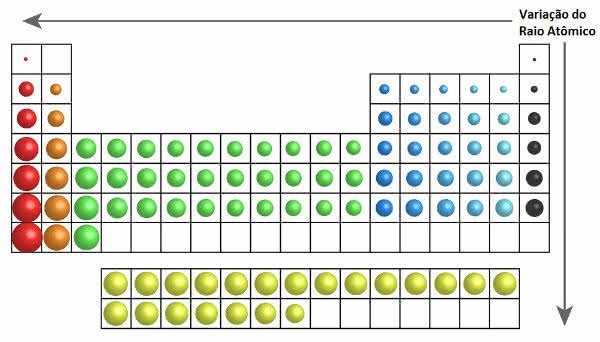 Variação do Raio Atômico na Tabela Periódica
Variação do Raio Atômico na Tabela Periódica
Sendo assim, na vertical (famílias ou grupos) o raio atômico aumenta de cima para baixo. Já na horizontal (períodos), eles aumentam da direita para esquerda.
Veja a variação inversa em Eletronegatividade.
Leia também:
ASTH, Rafael. Raio Atômico. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/raio-atomico/. Acesso em:



