Número Atômico
O número atômico, representado pela letra Z maiúscula, corresponde ao número de prótons existentes no núcleo dos átomos (Z = p).
Cada elemento químico possui um número atômico, ou seja, não existem átomos de elementos químicos distintos que apresentem o mesmo número atômico.
Por isso, os números atômicos dos elementos facilitam a classificação e a constituição da tabela periódica. Geralmente, eles são representados na parte inferior do elemento, enquanto a massa (A) está na parte superior: zXA
Estrutura do Átomo
O átomo é formado de partículas subatômicas chamadas de prótons (p), com carga positiva, de nêutrons (n), eletricamente neutros, e ainda por elétrons (e), de carga negativa.
Prótons e nêutrons estão localizados no núcleo dos átomos, enquanto os elétrons transitam pela eletrosfera, ou seja, em volta do núcleo.
Observe a imagem abaixo com um desenho hipotético de um átomo.
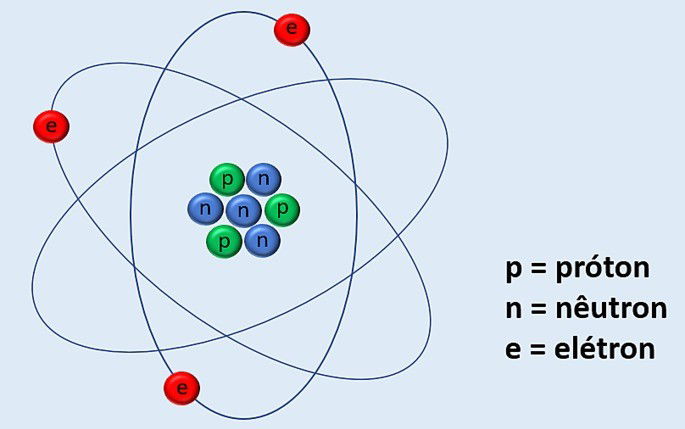
O núcleo é a região central e como o átomo do exemplo apresenta 3 prótons, então seu número atômico é 3 ( Z = 3).
O número atômico funciona como um código identificador dos elementos químicos, pois cada átomo de um elemento apresenta uma quantidade específica de prótons. Por isso, os 118 elementos na tabela periódica foram organizados por ordem crescente de número atômico.
Por exemplo, na natureza existem 3 isótopos do elemento hidrogênio (H): prótio (1H1), deutério (1H2) e trítio (1H3). Note que as massas são diferentes, mas o número atômico é sempre o mesmo.
Observe a seguir alguns exemplos de elementos químicos e seus respectivos números atômicos.
- 2He: o átomo de hélio apresenta número atômico 2, pois contém 2 prótons em seu núcleo.
- 11Na: o átomo de sódio apresenta número atômico 11, pois contém 11 prótons em seu núcleo.
- 20Ca: o átomo de cálcio apresenta número atômico 20, pois contém 20 prótons em seu núcleo.
Um átomo em seu estado fundamental é eletricamente neutro, ou seja, as cargas positivas e negativas devem estar na mesma quantidade. Portanto, se um átomo possui 3 prótons no núcleo, então existem 3 elétrons na sua eletrosfera.
Saiba mais sobre prótons, elétrons e nêutrons.
Número Atômico e Número de Massa
Vale destacar que o número atômico (Z) e o número de massa (A) são informações que compõem a estrutura dos elementos químicos.
Contudo, deve-se atentar aos conceitos para que não haja confusão, visto que o número atômico representa o número de prótons de um átomo, e o número de massa corresponde a soma do número de prótons e o número de nêutrons que existem no núcleo.
O número de massa é expresso pela seguinte fórmula:
A = p + n
Note que a partir dessa expressão, pode-se calcular também:
- Número de prótons: Z = A - n ou P = A - n
- Número de nêutrons: n = A - Z
Exemplo resolvido: Se o átomo do elemento químico sódio apresenta número de massa 23 e número atômico 11, quantos nêutrons existem em seu núcleo?
n = A – Z
n = 23 – 11
n = 12
Portanto, um átomo de sódio contém 11 prótons e 12 nêutrons em seu núcleo.
Exercícios Resolvidos sobre Número Atômico
1. Se número de nêutrons do átomo X é igual a 12 e seu número de massa (A) é 30, qual o valor do número atômico desse elemento?
Confira mais questões com resolução comentada em exercícios sobre átomos.
2. Qual o número atômico e o número de massa do átomo Y constituído de 17 prótons, 17 elétrons e 18 nêutrons?
Assista esse vídeo para entender melhor como é formado o Átomo
Confira questões de vestibulares com resolução comentada em: Exercícios sobre a Tabela Periódica.
BATISTA, Carolina. Número Atômico. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/numero-atomico/. Acesso em:


