Átomo
O átomo é a unidade fundamental da matéria e a menor fração capaz de identificar um elemento químico, pois detém sua identidade. O termo átomo deriva do grego e significa indivisível.
Ele é formado por um núcleo, que contém nêutrons e prótons, e por elétrons que circundam o núcleo.
Estrutura do átomo
O átomo é formado por pequenas partículas, também chamadas de partículas subatômicas: elétrons, prótons e nêutrons.
A maior parte da massa do átomo concentra-se no núcleo, uma pequena e densa região. O seu maior volume encontra-se na eletrosfera, local de espaços vazios, pois os elétrons orbitam ao redor do núcleo.
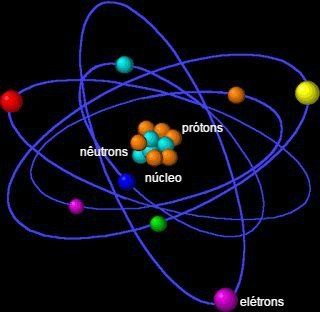
Elétrons
O elétron possui carga elétrica negativa (-1) e quase não possui massa, pois seu valor de 9,11 x 10-28 g e é cerca de 1840 vezes menor que a massa do núcleo. Eles são minúsculas partículas que giram muito rapidamente ao redor do núcleo atômico.
Os elétrons que se encontram nas regiões mais externas do átomo é que são responsáveis pela formação das ligações químicas, que ocorrem através da doação, recebimento ou compartilhamento de elétrons.
Prótons
O próton tem carga elétrica positiva (+1) de mesmo valor absoluto que a carga dos elétrons. Dessa forma, um próton e um elétron tendem a se atrair eletricamente.
Através dos prótons é possível distinguir os elementos químicos, pois cada átomo de um elemento apresenta um número definido de prótons em seu núcleo, o qual é chamado de número atômico.
Nêutrons
O nêutron não tem carga nenhuma, ou seja, é eletricamente neutro. Juntamente com os prótons, ele forma o núcleo atômico, que carrega toda a massa do átomo (99,9%). Tanto o próton quanto o nêutron possuem aproximadamente a massa de 1,67 x 10-24 g. Esse valor representa uma unidade de massa atômica 1 μ.
O nêutron proporciona estabilidade ao núcleo atômico, já que a força nuclear faz com que seja atraído por elétrons e prótons.
Apenas o átomo de hidrogênio não possui nêutrons, sendo constituído de apenas um elétron girando em torno de um próton.
Confira na tabela a seguir um resumo com as informações sobre as partículas subatômicas.
| Partícula | Símbolo |
Massa (em unidade de massa atômica) |
Carga (em unidade de carga elétrica - u.c.e) |
Localização |
|---|---|---|---|---|
| Próton | +1 | núcleo | ||
| Nêutron | 0 | núcleo | ||
| Elétron | -1 | eletrosfera |
Um átomo em seu estado fundamental é eletricamente neutro, pois o número de prótons é igual ao número de elétrons e as cargas que são opostas, positivas e negativas, se anulam.
Por exemplo, o sódio (Na) tem número atômico 11, ou seja, seu núcleo apresenta 11 prótons. Consequentemente, existem 11 elétrons na eletrosfera de um átomo desse elemento.
Leia mais sobre a estrutura atômica.
Composição do átomo
Como vimos, o átomo é formado por uma pequena e densa região central chamada de núcleo e ao redor dele há a eletrosfera, onde se encontram os elétrons, que pode ser dividida em camadas eletrônicas, subníveis energéticos e orbitais atômicos.
Camadas eletrônicas
O átomo apresenta níveis energéticos, que correspondem a sete camadas em torno de um núcleo e nelas estão os elétrons que orbitam ao redor. As camadas são denominadas de K, L, M, N, O, P e Q.

Cada camada pode conter um certo número de elétrons, conforme a tabela a seguir.
| Nível de energia | Camada eletrônica | Número máximo de elétrons |
|---|---|---|
| 1º | K | 2 |
| 2º | L | 8 |
| 3º | M | 18 |
| 4º | N | 32 |
| 5º | O | 32 |
| 6º | P | 18 |
| 7º | Q | 8 |
Por exemplo, o átomo de hélio (He) tem número atômico 2 e, por isso, apresenta 2 prótons no núcleo. Consequentemente, na eletrosfera do átomo há apenas 2 elétrons, que estão localizados na primeira e única camada eletrônica do átomo, a camada K que corresponde ao primeiro nível de energia.
Subníveis energéticos
Os níveis de energia abrigam subníveis, que são representados por s, p, d, f. Cada subnível acomoda um número máximo de elétrons, que é respectivamente 2, 6, 10 e 14.

Com essas informações é possível fazer a distribuição eletrônica de um átomo e saber a localização do elétron mais externo e mais energético.
Exemplo: Nitrogênio (N)
Número Atômico: 7
Distribuição eletrônica: 1s2 2s2 2p3
O átomo de nitrogênio apresenta dois níveis de energia, K e L, e seus 7 elétrons ocupam os subníveis s e p.
K: s2 = 2 elétrons
L: s2 + p3 = 5 elétrons
Observe que a camada L pode conter até 8 elétrons, mas no átomo de nitrogênio existem apenas 5 elétrons nessa camada.
Orbitais atômicos
Os orbitais caracterizam a região mais provável de se encontrar um elétron dentro de um subnível energético (s, p, d, f) em uma camada eletrônica (K, L, M, N, O, P, Q).
- Subnível s: apresenta 1 orbital que abriga até 2 elétrons
- Subnível p: apresenta 3 orbitais que abrigam até 6 elétrons
- Subnível d: apresenta 5 orbitais que abrigam até 10 elétrons
- Subnível f: apresenta 7 orbitais que abrigam até 14 elétrons

Utilizando o nitrogênio novamente como exemplo e distribuindo seus 7 elétrons em orbitais atômicos teríamos:

Veja também: Exercícios sobre Estrutura Atômica
Tipos de átomos
Observando o número de prótons, nêutrons e elétrons podemos comparar os átomos e classificá-los em isótopos, isóbaros e isótonos.
Um elemento químico pode ser definido como um grupo de átomos com o mesmo número de prótons. Esses átomos recebem o nome de isótopos, pois possuem o mesmo número atômico e diferentes massas.
Por exemplo, na natureza existem 3 isótopos do elemento hidrogênio (H): prótio , deutério
e trítio
.
Átomos de elementos químicos distintos podem ser classificados como isótonos quando apresentam número atômico e massas diferentes, mas o mesmo número de nêutrons.
Os isóbaros são átomos de elementos distintos, ou seja, apresentam número atômico diferente, mas o mesmo número de massa.
Leia mais sobre isótopos, isóbaros e isótonos.
Modelos de átomos (modelos atômicos)
O filósofo grego Aristóteles (384 a.C. - 322 a.C) tentou explicar a constituição de todas as substâncias a partir dos elementos terra, ar, fogo e água.
Demócrito (546 a.C - 460 a.C), cientista e matemático grego, formulou a ideia de haver um limite para a pequenez das partículas. Dizia ele que elas se tornariam tão pequenas que não mais poderiam ser divididas. Chamou de “átomo” essa partícula.
Durante a maior parte do século XIX, foi o Modelo Atômico de Dalton, cientista inglês, que propôs a teoria atômica, que foi muito além do pensamento dos antigos.
Essa teoria dizia que todas as substâncias são constituídas de pequenas partículas indivisíveis chamadas átomos, que seriam como bolas de bilhar. Conforme os estudos sobre a estrutura da matéria avançaram foi descoberto que o átomo é formado por outras pequenas partículas denominadas de subatômicas.
Com a descoberta do elétron, Thomson formulou o modelo conhecido como pudim de massas, que descrevia o átomo como uma esfera positiva com elétrons de carga negativa incrustados em sua superfície.
Através de experimentos o físico Rutherford constatou que o átomo possuía espaços vazios e elétrons ao redor de um núcleo extremamente pequeno e positivo. Assim, Rutherford propôs o modelo nuclear para representar o átomo.
Bohr melhorou o modelo proposto por Rutherford ao constatar que os elétrons não giram ao redor do núcleo ao acaso, mas sim em órbitas específicas. Esse modelo ficou conhecido como planetário.
Leia também sobre:
- Modelos atômicos
- Modelo atômico de Thomson
- Modelo atômico de Bohr
- Modelo atômico de Rutherford
- Evolução dos modelos atômicos
BATISTA, Carolina. Átomo. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/atomo/. Acesso em:


