Modelo Atômico de Bohr
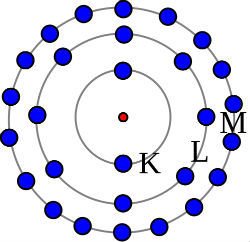
O Modelo Atômico de Bohr apresenta o aspecto de órbitas onde existem elétrons e, no seu centro, um pequeno núcleo.
O físico dinamarquês Niels Henry David Bohr (1885-1962) deu continuidade ao trabalho desenvolvido com Rutherford. Ele preencheu a lacuna que existia na teoria atômica proposta por Rutherford.
Por esse motivo, o átomo de Bohr pode também ser chamado de Modelo Atômico de Rutherford – Bohr.
Niels havia conhecido Rutherford no laboratório da Universidade de Cambridge e foi levado por ele à Universidade de Manchester onde passaram a trabalhar em conjunto.
Bohr conseguiu explicar como se comportava o átomo de hidrogênio, o que não era possível mediante a teoria atômica de Rutherford.
Mas, embora tenha aperfeiçoado o modelo atômico de Rutherford, o modelo de Bohr ainda não é perfeito, uma vez que continuam havendo lacunas por explicar.
Em 1913, Bohr promoveu experimentos que mostravam essas falhas e propunha um novo modelo.
Se o modelo proposto de Rutherford estivesse correto, ao serem acelerados, os elétrons emitiriam ondas eletromagnéticas. Na sequência, essas partículas perderiam energia e consequentemente colidiriam com o núcleo atômico.
O que acontece, na verdade, é que o elétron emite energia. Quanto maior a sua energia, mais afastado ele fica do núcleo do átomo.
Saiba mais sobre os modelos atômicos e a evolução dos modelos atômicos.
Postulados de Bohr
Mediante o trabalho que desenvolveu, Bohr obteve quatro princípios:
- Quantização da energia atômica (cada elétron apresenta uma quantidade específica de energia).
- Os elétrons se movem em uma órbita, as quais são chamadas de “estados estacionários”. Ao absorver energia, o elétron salta para uma órbita mais distante do núcleo.
- Quando absorve energia, o nível de energia do elétron aumenta saltando para uma camada mais externa. Por outro lado, ela diminui quando o elétron emite energia.
- Os níveis de energia, ou camadas eletrônicas, acomodam um número determinado de elétrons e são designados pelas letras: K, L, M, N, O, P, Q.
O modelo de Bohr estava ligado à Mecânica Quântica. Assim, a partir da década de 20, Erwin Schrödinger, Louis de Broglie e Werner Heisenberg, especialmente, dão o seu contributo no que respeita ao modelo da estrutura atômica.
Quer conhecer os outros modelos atômicos? Leia:
- Modelo Atômico de Dalton, o qual tem o aspecto de uma bola de bilhar
- Modelo Atômico de Thomson, também conhecido como “modelo pudim de ameixa” ou “pudim com passas” em decorrência do seu aspecto
- Modelo Atômico de Rutherford, o qual apresenta o aspecto de um sistema planetário.
Teste seus conhecimentos sobre o tema em: exercícios sobre modelos atômicos.
MAGALHÃES, Lana. Modelo Atômico de Bohr. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/modelo-atomico-de-bohr/. Acesso em:


