Exercícios sobre modelos atômicos
Teste seus conhecimentos com questões fáceis, médias e difíceis sobre os modelos atômicos propostos por Dalton, Thomson, Rutherford e Niels Bohr.
Questões de nível fácil
Questão 1
A imagem abaixo representa qual modelo atômico?
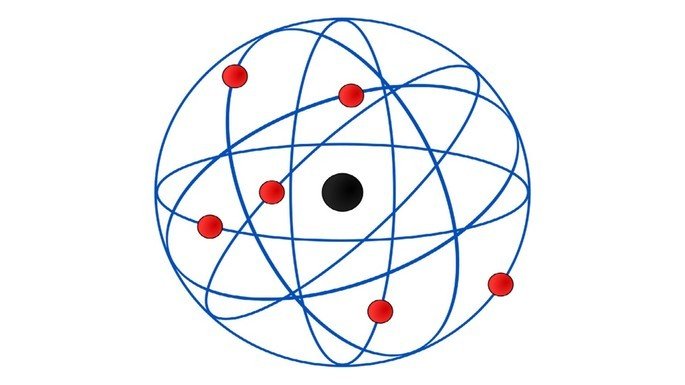
Questão 2
Qual cientista propôs o primeiro modelo atômico moderno que ficou conhecido como “bola de bilhar”?
a) Isaac Newton.
b) Demócrito.
c) John Dalton.
d) Ernest Rutherford.
Saiba mais sobre o modelo atômico de Dalton.
Questão 3
Assinale a alternativa incorreta:
a) As primeiras ideias relativas à estrutura interna dos átomos foram de Thomson.
b) No modelo atômico de Rutherford-Bohr, os elétrons que giram ao redor do núcleo não giram ao acaso, mas descrevem órbitas determinadas.
c) O modelo atômico de Dalton considerava a existência de cargas nos átomos.
d) Demócrito e Leucipo foram os primeiros a definir o conceito de matéria e átomo.
Questão 4
Sobre o modelo Rutherford, considere as afirmações abaixo como verdadeiras ou falsas:
a) O Modelo Atômico de Rutherford sugere que o átomo apresenta o aspecto de um sistema planetário.
b) O Modelo Atômico de Rutherford ficou conhecido como “modelo pudim de ameixa” ou “pudim com passas” em decorrência do seu aspecto.
c) No Modelo Atômico de Rutherford, os elétrons giram em torno do núcleo (formado por prótons e nêutrons), de forma semelhante aos planetas que giram à volta do Sol.
d) O Modelo Atômico de Rutherford é também chamado de “Modelo Atômico de Rutherford-Bohr”
Saiba mais sobre o modelo atômico de Rutherford.
Questão 5
Os modelos atômicos descrevem alguns aspectos estruturais dos átomos. Sobre essa afirmação podemos afirmar que:
a) Os modelos atômicos foram desenvolvidos pelos cientistas gregos Leucipo e Demócrito.
b) Os principais modelos atômicos são: Modelo de Rutherford e o Modelo de Rutherford-Bohr.
c) O primeiro modelo atômico desenvolvido foi o Modelo Atômico de Rutherford.
d) Os modelos atômicos foram desenvolvidos por cientistas com o intuito de compreender melhor o átomo e a sua composição.
Saiba mais sobre os modelos atômicos.
Questões nível médio
Questão 6
(UFJF-MG) Associe as afirmações a seus respectivos responsáveis:
I - O átomo não é indivisível e a matéria possui propriedades elétricas (1897).
II - O átomo é uma esfera maciça (1808).
III - O átomo é formado por duas regiões denominadas núcleo e eletrosfera (1911).
a) I - Dalton, II - Rutherford, III - Thomson.
b) I - Thomson, II - Dalton, III - Rutherford.
c) I - Dalton, II - Thomson, III - Rutherford.
d) I - Rutherford, II - Thomson, III - Dalton.
e) I - Thomson, II - Rutherford, III - Dalton.
Saiba mais sobre o átomo.
Questão 7
(UFRGS) Considere as seguintes afirmações a respeito do experimento de Rutherford e do modelo atômico de Rutherford-Bohr.
I - A maior parte do volume do átomo é constituída pelo núcleo denso e positivo.
II - Os elétrons movimentam-se em órbitas estacionárias ao redor do núcleo.
III- O elétron, ao pular de uma órbita mais externa para uma mais interna, emite uma quantidade de energia bem definida.
Quais estão corretas?
a) Apenas I.
b) Apenas II.
c) Apenas III.
d) Apenas II e III.
e) I, II e III.
Saiba mais sobre a estrutura atômica.
Questão 8
(Vunesp-adaptada) Em 1913, Niels Bohr (1885-1962) propôs um modelo que fornecia uma explicação para a origem dos espectros atômicos. Nesse modelo, Bohr introduziu uma série de postulados, dentre os quais, a energia do elétron só pode assumir certos valores discretos, ocupando níveis de energia permitidos ao redor do núcleo atômico. Considerando o modelo de Bohr, os diferentes espectros atômicos podem ser explicados em função
a) do recebimento de elétrons por diferentes elementos.
b) da perda de elétrons por diferentes elementos.
c) das diferentes transições eletrônicas, que variam de elemento para elemento.
d) da promoção de diferentes elétrons para níveis mais energéticos.
e) da instabilidade nuclear de diferentes elementos.
Saiba mais sobre o modelo atômico de Bohr.
Questão 9
(PUC-RS) A aceitação histórica da ideia de que a matéria é composta de átomos foi lenta e gradual. Na Grécia antiga, Leucipo e Demócrito são lembrados por terem introduzido o conceito de átomo, mas suas propostas foram rejeitadas por outros filósofos e caíram no esquecimento. No final do século XVIII e início do século XIX, quando as ideias de Lavoisier ganhavam aceitação generalizada, surgiu a primeira teoria atômica moderna, proposta por _______. Essa teoria postulava que os elementos eram constituídos de um único tipo de átomo, enquanto que as substâncias compostas eram combinações de diferentes átomos segundo proporções determinadas. Quase cem anos depois, estudos com raios catódicos levaram J. J. Thomson à descoberta do _______, uma partícula de massa muito pequena e carga elétrica _______, presente em todos os materiais conhecidos. Alguns anos depois, por meio de experimentos em que uma fina folha de ouro foi bombardeada com partículas alfa, Rutherford chegou à conclusão de que o átomo possui em seu centro um _______ pequeno, porém de massa considerável.
As palavras que preenchem as lacunas correta e respectivamente estão reunidas em
a) Dalton – elétron – negativa – núcleo
b) Bohr – cátion – positiva – elétron
c) Dalton – nêutron – neutra – próton
d) Bohr – fóton – negativa – ânion
e) Dalton – próton – positiva – núcleo
Saiba mais sobre os elétrons.
Questão 10
(ESPM-SP) O átomo de Rutherford (1911) foi comparado ao sistema planetário (o núcleo atômico representa o sol e a eletrosfera, os planetas):
Eletrosfera é a região do átomo que:
a) contém as partículas de carga elétrica negativa.
b) contém as partículas de carga elétrica positiva.
c) contém nêutrons.
d) concentra praticamente toda a massa do átomo.
e) contém prótons e nêutrons.
Saiba mais sobre os prótons.
Questões nível difícil
Questão 11
(Udesc) Considerando os modelos atômicos mais relevantes, dentro de uma perspectiva histórica e científica, assinale a alternativa correta.
a) Até a descoberta da radioatividade, o átomo era tido como indivisível (Dalton). O modelo que o sucedeu foi de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
b) No modelo de Dalton, o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera. O modelo seguinte foi o de Bohr que introduziu a ideia de que os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao modelo do sistema solar.
c) No modelo atômico de Dalton, o átomo era tido como indivisível. O modelo sucessor foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado negativamente e uma eletrosfera.
d) O modelo de Dalton propunha que o átomo era formado por uma massa carregada positivamente com os elétrons distribuídos nela. O modelo seguinte foi o de Rutherford, no qual o átomo era constituído de um núcleo carregado positivamente e uma eletrosfera.
e) No modelo atômico de Dalton, os elétrons ocupam orbitais com energias definidas, este modelo se assemelha ao do sistema solar. O modelo que o sucedeu foi o de Thomson, que propunha o átomo ser formado por uma massa carregada positivamente com os elétrons distribuídos nela.
Saiba mais sobre o modelo atômico de Thomson.
Questão 12
(FAME) O modelo proposto por Bohr introduziu um único número quântico para descrever o comportamento do elétron no átomo. O modelo da mecânica quântica usa três números quânticos.
Sobre os números quânticos propostos no modelo de Bohr e no modelo da mecânica quântica, é CORRETO afirmar que
a) o modelo atômico de Bohr está relacionado a um número quântico que descreve sobre a orientação dos orbitais.
b) o número quântico azimutal tem valores positivos e inteiros e à medida que esse número quântico aumenta, o orbital torna-se maior.
c) o nível com o número quântico principal n consistirá em n subníveis, e cada subnível corresponde a um valor permitido diferente do número quântico secundário entre 1 e n-1.
d) as energias relativas do elétron nos orbitais do átomo de hidrogênio têm valores diferentes quando o elétron estiver nos orbitais de mesmo subnível.
Saiba mais sobre os números quânticos.
Questão 13
(UFAL) Um dos experimentos conduzidos pela equipe de Rutherford revolucionou o modo como os físicos da época passaram a imaginar o átomo. Ele consistiu no bombardeamento de finas lâminas de ouro para estudo de deflexões (desvios) de partículas alfa. De acordo com o modelo atômico proposto por Rutherford, dadas as afirmativas seguintes
I. O núcleo atômico é extremamente pequeno em relação ao tamanho do átomo e é no núcleo onde são encontrados os prótons e nêutrons.
II. O átomo é uma esfera de carga positiva na qual estariam incrustados os elétrons de carga negativa.
III. A matéria é constituída de átomos que são partículas indivisíveis e indestrutíveis.
IV. O átomo é constituído por duas regiões distintas: um núcleo denso, muito pequeno, e uma região de volume muito grande, ocupada pelos elétrons, a eletrosfera.
verifica-se que estão corretas
a) I, II, III e IV.
b) II e IV, apenas.
c) II e III, apenas.
d) I, III e IV, apenas.
e) I e IV, apenas.
Saiba mais sobre os nêutrons.
Questão 14
(Udesc) A eletricidade (do grego elétron, que significa âmbar) é um fenômeno físico originado por cargas elétricas. Há dois tipos de cargas elétricas: positivas e negativas. As cargas de nomes iguais (mesmo sinal) se repelem e as de nomes distintos (sinais diferentes) se atraem. De acordo com a informação, assinale a alternativa correta.
a) O fenômeno descrito acima não pode ser explicado utilizando-se o modelo atômico de Dalton.
b) O fenômeno descrito acima não pode ser explicado utilizando-se o modelo atômico de Thomson.
c) Os prótons possuem carga elétrica negativa.
d) O fenômeno descrito acima não pode ser explicado utilizando-se o modelo atômico de Rutherford.
e) Os elétrons possuem carga elétrica positiva.
Questão 15
(PUC-RS) John Dalton foi o responsável por introduzir no âmbito da ciência a teoria atômica, nos primeiros anos do século XIX. Nessa época, ainda não se conseguia saber quantos átomos de cada elemento entravam na composição das moléculas simples. Hoje sabemos que a fórmula da molécula da água é H2O e que a da amônia é NH3. Dalton supôs que as moléculas mais simples eram combinações 1:1; assim, a água seria HO e a amônia, NH. Dalton introduziu uma escala de massas atômicas baseada no hidrogênio, que tinha massa 1.
Na época de Dalton, acreditava-se que, em massa, a água tinha 1/8 de hidrogênio, e que a amônia tinha 1/6 de hidrogênio. Com isso, foi possível concluir que as massas atômicas do oxigênio e do nitrogênio valiam, respectivamente,
a) 7 e 5.
b) 8 e 6.
c) 9 e 7.
d) 16 e 14.
e) 32 e 28.
Leia sobre a Evolução dos Modelos Atômicos.
Confira mais questões com resolução comentada em Exercícios sobre Átomos e Exercícios sobre Estrutura Atômica.
BATISTA, Carolina. Exercícios sobre modelos atômicos. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-modelos-atomicos/. Acesso em:


