Números Quânticos: principal, secundário, magnético e de spin
Os números quânticos são quatro:
- Principal (n);
- Secundário (l);
- Magnético (m ou ml);
- Spin (s ou mS).
Eles têm a função de localizar os elétrons na eletrosfera de um átomo, motivo pelo qual não existem elétrons que tenham os quatro números quânticos iguais.
Número quântico principal
O número quântico principal (n) é aquele que indica os níveis de energia, ou seja, a camada eletrônica em que o elétron está.
As camadas eletrônicas K, L, M, N, O, P e Q em torno do núcleo atômico são representadas, respectivamente, pelos seguintes números quânticos principais 1, 2, 3, 4, 5, 6 e 7:
| Nível de energia |
Camada eletrônica |
Número quântico princial |
Número máximo de elétrons |
|---|---|---|---|
| 1º | K | 1 | 2 |
| 2º | L | 2 | 8 |
| 3º | M | 3 | 18 |
| 4º | N | 4 | 32 |
| 5º | O | 5 | 32 |
| 6º | P | 6 | 18 |
| 7º | Q | 7 | 8 |
Por exemplo, o átomo de hidrogênio apresenta apenas um próton em seu núcleo e, consequentemente, um elétron na sua eletrosfera. Este elétron está localizado na primeira camada eletrônica, logo, seu número quântico principal é 1.
Leia sobre camada de valência.
Número quântico secundário
O número quântico secundário, azimutal ou de momento angular (l) é aquele que indica os subníveis de energia, ou seja, o subnível energético a que o elétron pertence.
Os subníveis de energia s, p, d e f representam, respectivamente, os seguintes números quânticos secundários 0, 1, 2 e 3:
s: l = 0;
p: l = 1;
d: l = 2;
f: l = 3.
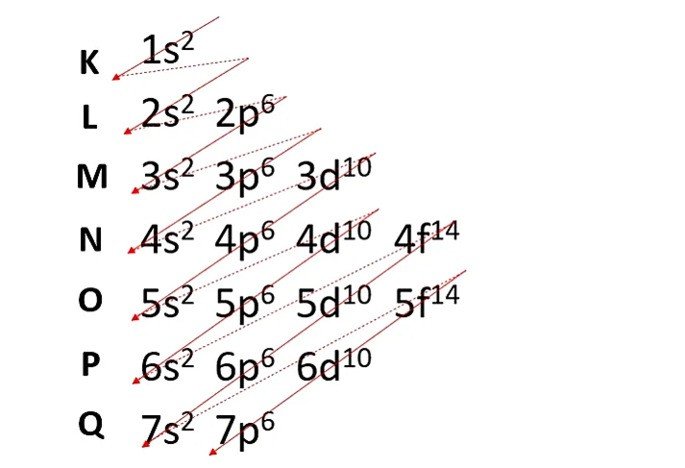
Observe que cada subnível permite um número máximo de elétrons: s = 2; p = 6; d = 10 e f = 14.
Leia sobre Diagrama de Pauling.
Número quântico magnético
O número quântico magnético (m ou m1) é aquele que indica os orbitais no espaço onde os elétrons se encontram, ou seja, a região mais provável de encontrar um elétron dentro de um subnível de energia.
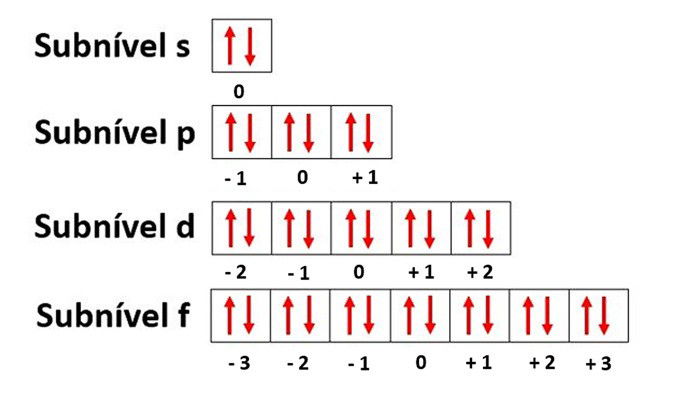
- O subnível s possui 1 orbital, que é o orbital (0) e abriga até 2 elétrons;
- O subnível p possui 3 orbitais, que são os orbitais (0), (+1) e (-1) e abrigam até 6 elétrons;
- O subnível d possui 5 orbitais, que são os orbitais (-2), (-1), (0), (+1) e (+2) e abrigam até 10 alétrons;
- O subnível f possui 7 orbitais, que são os orbitais (-3), (-2), (-1), (0), (+1), (+2) e (+3) e abrigam até 14 elétrons.
Número quântico de spin
O número quântico de spin (s ou mS) é aquele que indica o sentido de rotação do elétron dentro de um orbital.
Um orbital abriga no máximo dois elétrons. Se a rotação do elétron é no sentido negativo, a seta que o representa está direcionada para cima e o número quântico spin é -1/2.
Em contrapartida, se o orbital de um subnível for positivo, a rotação é no sentido positivo, o qual é representado por uma seta para baixo e o número quântico spin é +1/2.
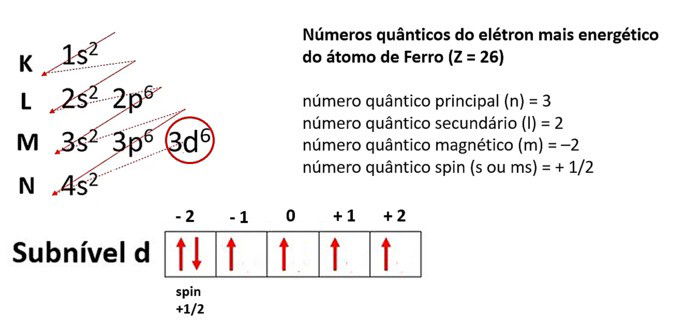
Exemplo do elemento ferro (26Fe)
Distribuição eletrônica do ferro: 1s2 2s2 2p6 3s2 3p6 4s2 3d6
- Tendo em conta que o seu elétron mais energético se encontra na camada 3, então, n = 3;
- Seu subnível é d, então, l = 2;
- O subnível d possui 5 orbitais. Ao distribuir os elétrons, o último fica no orbital -2, então, m = -2.
- O spin (s) é +½ , de acordo com o sentido do último elétron preenchido no orbital.
Resumo sobre números quânticos
| Principal (n) | Subnível energético |
Secundário (l) | Magnético (m) |
|---|---|---|---|
| 1 | 1s | 0 | |
| 2 |
2s 2p |
0 1 |
|
| 3 |
3s 3p 3d |
0 1 2 |
|
| 4 |
4s 4p 4d 4f |
0 1 2 3 |
|
| 5 |
5s 5p 5d 5f |
0 1 2 3 |
|
| 6 |
6s 6p 6d |
0 1 2 |
|
| 7 | 7s | 0 |
O que é distribuição eletrônica?
A distribuição eletrônica é a forma como os elementos químicos são ordenados de acordo com a sua energia. É a partir dela que os números quânticos conseguem localizar os elétrons.
Exercícios resolvidos sobre números quânticos
Questão 1
(UFPA) Os números quântico principal “n” , secundário “l”, magnético “m” do elétron mais energético do átomo de cloro são respectivamente:
(Dado Cl: Z=17)
a) 3, 1, 0
b) 3, 1, +1
c) 2, 0, +1
d) 2, 1, -1
e) 2, 3, 0
Questão 2
(UERN/2015) A principal aplicação do bromo é a produção de brometo de etileno, que é utilizado em combustíveis para motores, com o intuito de evitar a acumulação de chumbo no interior dos cilindros.
Considerando que o número atômico do bromo é 35, afirma-se que ele possui:
I. O número quântico principal igual a 4.
II. 3 orbitais completos.
III. 5 elétrons no nível de valência.
IV. O número quântico magnético igual a 0.
V. 5 elétrons na última camada, com número quântico azimutal igual a 1.
Estão corretas apenas as afirmativas
a) I e IV.
b) I, II e V.
c) III, IV e V.
d) I, II, IV e V.
Adquira mais conhecimento com os conteúdos:
- Tabela Periódica
- Raio atômico
- Modelos Atômicos
- Exercícios sobre a Tabela Periódica
- Exercícios sobre Estrutura Atômica
Referências Bibliográficas
ATKINS, P. W.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006.
BROWN, T.; LEMAY, H. E.; BURSTEN, B. E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.
BRADY, J. E.; HUMISTON, G.E. Química Geral; Tradução por Cristina Maria Pereira dos Santos e Roberto de Barros Faria. 2ª ed. Rio de Janeiro: Livros Técnicos e Científicos, 1996.
BATISTA, Carolina. Números Quânticos: principal, secundário, magnético e de spin. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/numeros-quanticos/. Acesso em:


