Isótopos, isóbaros e isótonos: entenda suas diferenças
Os isótopos, isóbaros e isótonos são classificações dos átomos de elementos químicos presentes na tabela periódica. Essa classificação ocorre devido a quantidade de prótons, elétrons e nêutrons existentes em cada um deles.
Assim, temos que:
- Isótopos: são átomos que possuem o mesmo número de prótons.
- Isótonos: são elementos que possuem o mesmo valor de nêutrons;
- Isóbaros: são elementos que possuem o mesmo valor de massa.
Vale lembrar que, os prótons possuem carga positiva, os elétrons, carga negativa e os nêutrons não possuem carga. Cada uma dessas subpartículas ocupam um lugar no átomo, por exemplo, os prótons e nêutrons no núcleo e os elétrons, na eletrosfera.
Elemento Químico
Cada elemento química é representado por um símbolo, que é uma letra. Por exemplo, o hidrogênio tem símbolo H, o oxigênio o O, o Cloro o Cl, o potássio, o K, e por aí vai. Além do símbolo, há como expressar, em uma notação completa, a massa (A) e o número atômico (Z).
Dessa maneira, temos:
o elemento X qualquer, possui uma massa, representada pelo A e um número atômico simbolizado pelo Z.
Número Atômico (Z)
O número atômico (Z) representa a quantidade de prótons presentes em cada átomo.
O número de prótons sempre será igual ao de elétrons, em um elemento em estado fundamental, ou seja, eletricamente neutro.
Número de Massa (A)
O número de massa (A) de cada átomo, corresponde a soma dos prótons e dos nêutrons (A= p + n) presentes no núcleo do elemento.
Importante notar que o elétron, na medida que possui uma massa insignificante, isto é, 1836 vezes menor em relação aos prótons e nêutrons, não estão inclusos na soma das massas dos elementos químicos. Por esse motivo, o número de massa não corresponde a massa efetiva ou real do átomo.
Isótopos
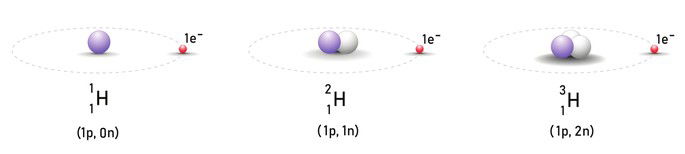
Os isótopos (isotopia) são átomos de um mesmo elemento químico os quais apresentam o mesmo número atômico (Z) e diferentes números de massa (A).
Isóbaros
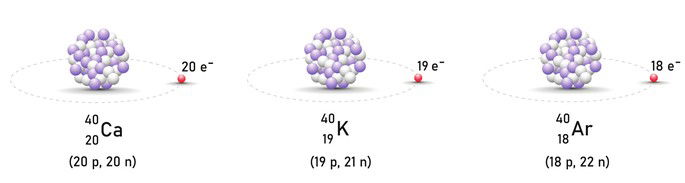
Os isóbaros (isobaria) são átomos de distintos elementos químicos os quais apresentam o mesmo número de massa (A) e diferentes números atômicos (Z).
Isótonos
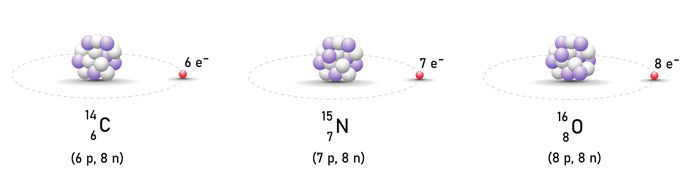
Os isótonos (isotonia) são átomos de elementos químicos distintos os quais apresentam diferentes números atômicos (Z), diferentes números de massa (A) e o mesmo número de nêutrons.
Exercícios
- Segundo a representação dos elementos químicos abaixo, o cálcio (Ca), o potássio (K) e o argônio (Ar) podemos classificá-los como isótopos, isótonos ou isóbaros?
Se na representação do elemento químico, o número de massa corresponde a soma dos prótons e dos nêutrons (A= p + n) na representação acima, nota-se que os números que aparecem na parte superior da letra são iguais: 40.
Para resolver a situação precisamos encontrar o valor de nêutron de cada elemento. Sendo assim, façamos o seguinte:
Portanto, se subtrairmos a massa do número de prótons, obteremos o valor de nêutron. Logo:
Dessa forma, conclui-se que o cálcio, o potássio e o argônio são elementos isóbaros, visto que só possuem o mesmo número de massa (A).
- De acordo com a classificação dos elementos químicos (isótopos, isóbaros e isótonos), agrupe os átomos apresentados:
Observe que os elementos acima possuem valores de massa e número atômico. Número atômico é igual à próton, portanto, o único valor que falta saber é o de nêutrons. Isso é possível através da fórmula A = p + n.
Usando essa fórmula será possível classificá-los em isóbaro, isótono e isótopo. Assim, temos que:
Elemento A:
A = p + n
232 = 90 + n
232 - 90 = n
142 = n
Elemento B:
A = p + n
234 = 91 + n
234 - 91 = n
143 = n
Elemento C:
A = p + n
233 = 90 + n
143 = n
Elemento D:
A = p + n
233 = 92 + n
141 = n
Elemento E:
A = p + n
234 = 93 + n
141 = n
Logo,
- Os elementos
são isótopos, pois possuem o mesmo número atômico e diferentes números de massa;
- Os elementos (
) e (
) são isóbaros, uma vez que possuem mesmo número de massa e diferentes números atômicos;
- Os elementos (
) e (
) são isótonos, pois apresentam o mesmo número de nêutrons e diferentes números de massa e número atômico.
Leia também:
Teste seus conhecimentos com exercícios sobre estrutura atômica.
CASTILHO, Rubens. Isótopos, isóbaros e isótonos: entenda suas diferenças. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/isotopos-isobaros-e-isotonos/. Acesso em:


