Eletronegatividade: o que é e como identificar (com tabela)
A eletronegatividade é uma propriedade periódica que indica a tendência de um átomo atrair elétrons. Ela ocorre quando o átomo está envolvido em uma ligação química covalente, onde ocorre o compartilhamento de um ou mais pares de elétrons.
O que a determina é a capacidade do núcleo atômico para atrair elétrons vizinhos. A partir daí, segundo a Teoria de Octeto, são formadas moléculas estáveis.
A eletronegatividade é importante para entender como os átomos interagem entre si e influencia nas propriedades das substâncias químicas.
As outras propriedades periódicas são: afinidade eletrônica, eletropositividade, potencial de ionização e raio atômico.
Variação da eletronegatividade na Tabela Periódica
Os elementos mais eletronegativos são os que se encontram do lado direito e na parte superior da tabela periódica.
À medida que os elementos se distanciam dessa posição, ou seja, quanto mais se dirijam para a esquerda e para a parte inferior, menos eletronegativos eles são.
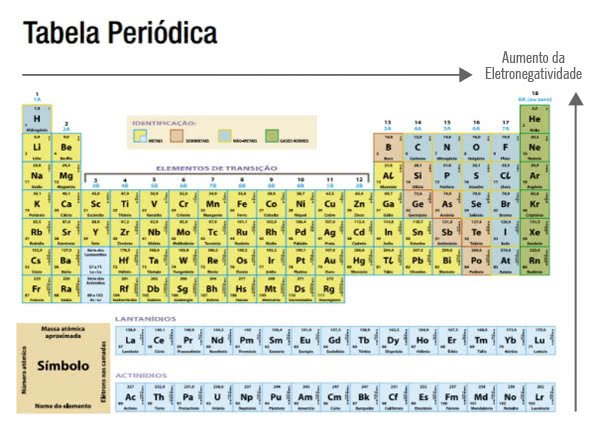
O flúor (F) é o elemento químico mais eletronegativo. Embora ele não seja o elemento que está mais posicionado do lado direito da tabela, ele é o primeiro após a coluna dos gases nobres.
Os gases nobres, normalmente, não fazem ligações químicas e, por esse motivo, a sua eletronegatividade é baixa.
Enquanto isso, Césio (Cs) e Frâncio (Fr) são os elementos menos eletronegativos.
O inverso acontece quanto ao tamanho do raio atômico. Dessa forma, pode-se dizer que quanto maior o raio atômico, menor a eletronegatividade de um elemento.
O que é eletropositividade?
Eletropositividade é a tendência que os átomos têm em ceder elétrons. É também conhecida como caráter metálico pelo fato de os metais serem os elementos mais eletropositivos.
Na eletropositividade os elétrons são perdidos, o que faz com que a carga dos átomos fique positiva. Na eletronegatividade, por sua vez, os elétrons são acrescentados aos átomos. Logo, sua carga fica negativa.
Siga aprendendo com os seguintes conteúdos:
- Afinidade eletrônica
- Potencial de ionização
- Raio atômico
- Ligação Covalente
- Tabela Periódica
- Moléculas polares e apolares
CASTILHO, Rubens. Eletronegatividade: o que é e como identificar (com tabela). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/eletronegatividade/. Acesso em:


