Ligação Covalente
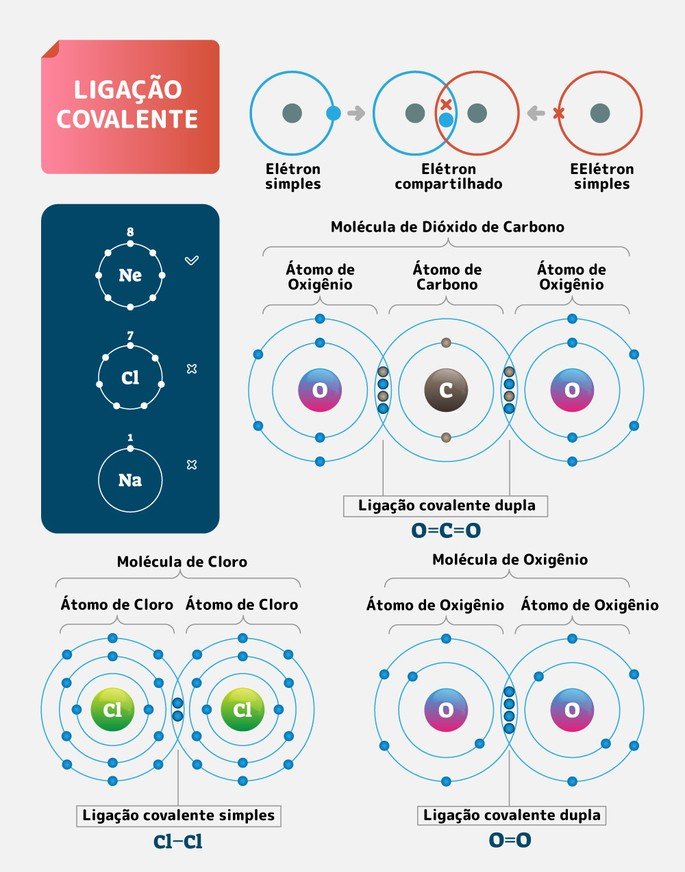
A Ligação Covalente, ou Ligação Molecular, ocorre quando há compartilhamento de um ou mais pares de elétrons entre os átomos. Seu objetivo é formar moléculas estáveis, conforme expressa a Regra do Octeto.
A Regra do Octeto fala que:
"um átomo adquire estabilidade quando possui 8 elétrons na camada de valência (camada eletrônica mais externa), ou 2 elétrons quando possui apenas uma camada".
É um tipo de ligação química que ocorre, majoritariamente, entre ametais, ou seja, elementos não metais. Além, dos ametais, o hidrogênio também participa efetivamente desse tipo de ligação química para se estabilizar na natureza.
Características das Ligações Covalentes
Quando dois, ou mais, átomos realizam ligação covalente é possível haver formação de polos parciais, um negativo (ð-) e outro positivo (ð+). Esse evento é previsível, bastando observar a diferença de eletronegatividade entre os envolvidos.
A eletronegatividade traduz a capacidade de um átomo de atrair elétrons para si, similar a um ímã. Dessa forma, quando dois átomos se ligam, aquele com maior eletronegatividade atrai, fortemente, os elétrons do outro para si.
Esse fenômeno poderá gerar uma conformação geométrica específica na molécula, conferindo formas variadas de uma substância no espaço. Dessa maneira, os químicos conseguem prever a geometria molecular de uma substância.
Saiba mais: Eletronegatividade.
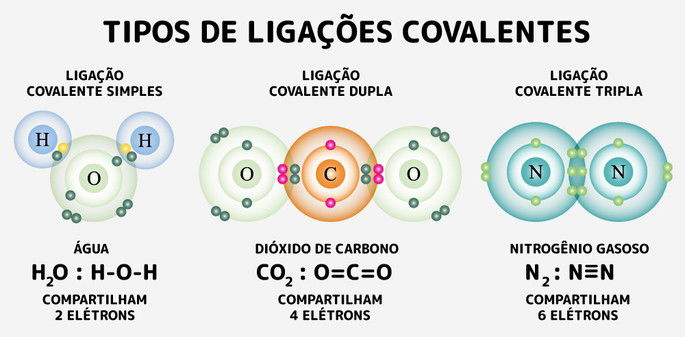
Ligações Covalentes Simples, Duplas e Triplas
Visando atingir a estabilidade na natureza, os átomos, compartilham um, dois ou três pares de elétrons entre si. Dessa forma, quando os átomos fazem uma ligação eles compartilham um par de elétrons, duas ligações dois pares e três ligações três pares.
É possível saber quantas ligações cada átomo precisa realizar para completar seu octeto, observando a tabela periódica ou realizando a distribuição eletrônica.
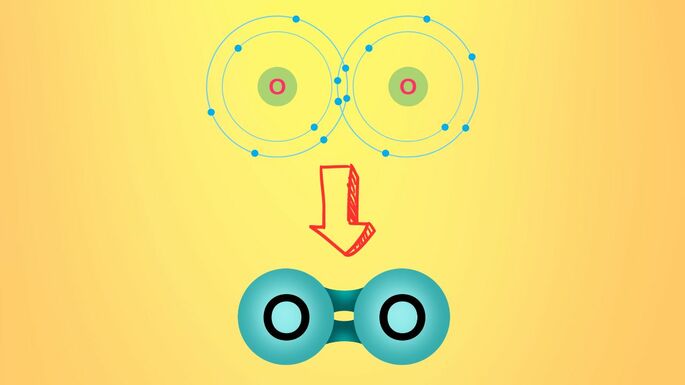
Por exemplo, o oxigênio encontra-se no grupo 6A da tabela periódica, logo, ele possui 6 elétrons na camada de valência. Portanto, para completar o octeto precisa realizar duas ligações para, dessa forma, obter o par faltante.
Essas ligações poderão ser duas simples ou uma dupla, o importante é ter dois elétrons orbitando em sua eletrosfera,
Contudo, para saber a demanda de elétrons dos metais de transição, é necessário realizar a distribuição eletrônica para entender quantas ligações precisam realizar para completar o octeto.
Apesar de pouco comum, metais de transição realizam ligações covalentes como, por exemplo, o óxido de cobre (II) (CuO).
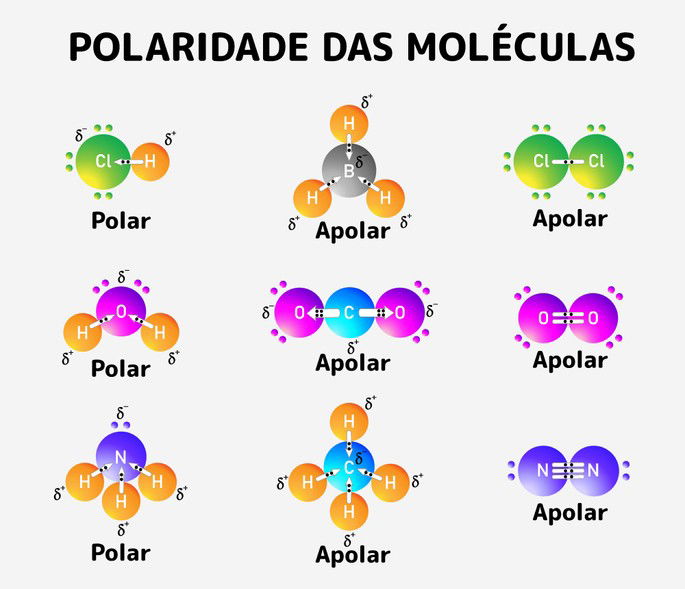
Polaridade das Moléculas
Quando ocorre ligação covalente é importante perceber a diferença de eletronegatividade entre os envolvidos. Elementos muito eletronegativos, tais como:
- Flúor = 4,0 (o mais eletronegativo da natureza);
- Oxigênio = 3,5;
- Nitrogênio = 3,0.
Tendem a agir como um grande ímã, atraindo tudo para si. Com isso, puxa a nuvem eletrônica do elemento menos eletronegativo, gerando tensões nas ligações químicas. Assim, se formam as diferentes geometrias moleculares das substâncias e se estabelece o conhecimento acerca das moléculas serem polares ou apolares.
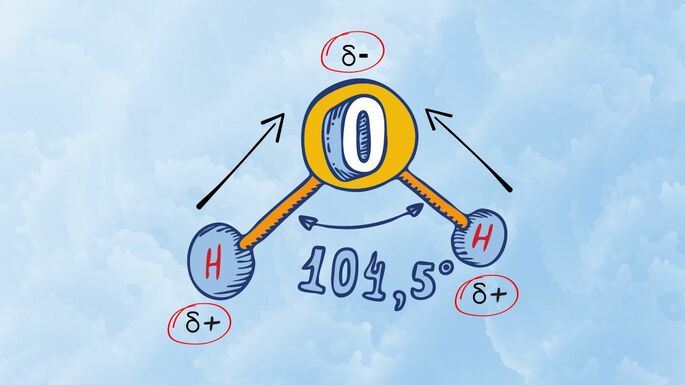
Diferenças significativas de eletronegatividade entre os átomos formam vetores, isto é, conferem uma direção e sentido na atração que ocorre entre os átomos.
Por exemplo, na molécula da água, o oxigênio possui o valor 3,5 de eletronegatividade, o hidrogênio 2,1. Portanto, forma-se um vetor que direciona a nuvem eletrônica dos hidrogênios para o oxigênio. Por esse motivo, pode-se dizer que a molécula de água é polar e sua geometria molecular é angular.
A imagem abaixo mostra alguns exemplos de moléculas polares e apolares para melhor compreensão.
Saiba mais: Moléculas polares e apolares.
Exemplos de Ligações Covalentes
Todas as substâncias moleculares são formadas por ligações covalentes. Portanto, todo composto químico que possui um desenho molecular é um exemplo de substância formada por ligação covalente. Algumas moléculas são:
- A água = H2O: H - O - H;
- O oxigênio atmosférico = O2: O - O;
- O gás flúor = F2: F - F.
- A glicose = C6H12O6;
- A cafeína = C8H10N4O2;
- O álcool (etanol) = C2H5OH;
- A aspirina = C9H8O4;
- O ácido cítrico = C6H8O7.
Ligação Covalente Coordenada ou Dativa
Nessa ligação covalente especial, os átomos se ligam pelo mesmo princípio, completar o octeto. Contudo, ela ocorre quando um dos átomos envolvidos não completou 8 elétrons na camada de valência, mesmo após o compartilhamento.
Sendo assim, o átomo que não completou 8 elétrons precisa receber mais elétrons para completar seu octeto. Porém, o outro átomo que já completou o seu não poderá fazer novas ligações, contudo, existem, em sua eletrosfera, elétrons livres.
Serão esses elétrons livres, ou seja, sem compartilhamento, que serão compartilhados com o outro átomo que ainda não completou o seu octeto. Um exemplo de ligação coordenada é o monóxido de carbono (CO).
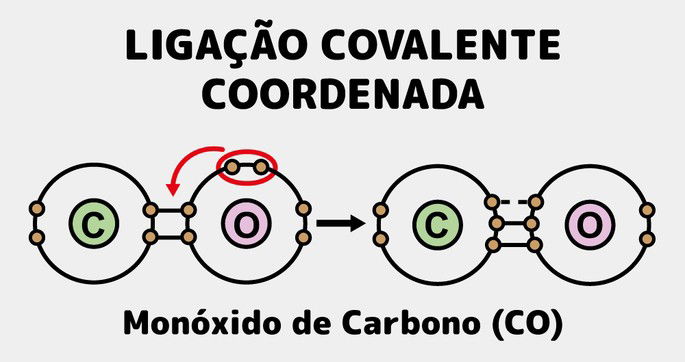
No monóxido de carbono, o oxigênio precisa compartilhar um par de elétrons, pois possui 6 na última camada. O carbono, precisa de dois pares para compor seu octeto, pois possui 4 elétrons na última camada.
Quando se ligam, um par do oxigênio é compartilhado com um par do carbono, o oxigênio se completa, mas o carbono não. No entanto, o oxigênio possui dois pares livres, ou seja, que não participam da ligação.
Como o carbono ainda precisa de um par para se estabilizar, dessa forma, o oxigênio, compartilha o que falta e a molécula se estabiliza. Assim se configura uma ligação covalente coordenada, ou dativa.
Leia mais:
- Ligações Químicas
- Exercícios de Ligações Químicas
- Forças Intermoleculares
- Camada de Valência
- Regra do Octeto
- Substâncias simples e compostas
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005.
CASTILHO, Rubens. Ligação Covalente. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/ligacao-covalente/. Acesso em:


