Polaridade das ligações
Ligações químicas são classificadas em polares ou apolares.
Enquanto que toda ligação iônica é polar, a polaridade da ligação covalente depende dos átomos presentes na molécula.
Uma ligação covalente é apolar quando apenas átomos de um mesmo elemento químico estão unidos; já quando são elementos diferentes, há diferença de eletronegatividade e a molécula é polar.
A polaridade ocorre devido à formação de polos nas substâncias químicas, que são positivos e negativos de acordo com as cargas. Por isso, a capacidade de atrair elétrons faz com que compostos iônicos possuam polaridade máxima, pois tendem a formar espécies químicas carregadas eletricamente.
Ligações polares e apolares
A eletronegatividade é uma propriedade periódica que representa a capacidade que um átomo tem de atrair para si os elétrons de uma ligação estabelecida com outro átomo.
A diferença de eletronegatividade entre átomos classifica as ligações em polar e apolar.
- Ligações apolares: os átomos envolvidos na ligação possuem diferença de eletronegatividade igual ou muito próxima de zero.
- Ligações polares: a diferença de eletronegatividade entre os átomos da ligação é diferente de zero.
Veja esses exemplos:
| Substância | Eletronegatividade | Diferença de eletronegatividade |
|---|---|---|
| Cl2 | ||
| HCl |
Como a molécula de cloro é formada por átomos de um único elemento químico, ela não apresenta diferença de eletronegatividade, sendo assim, sua ligação é apolar.
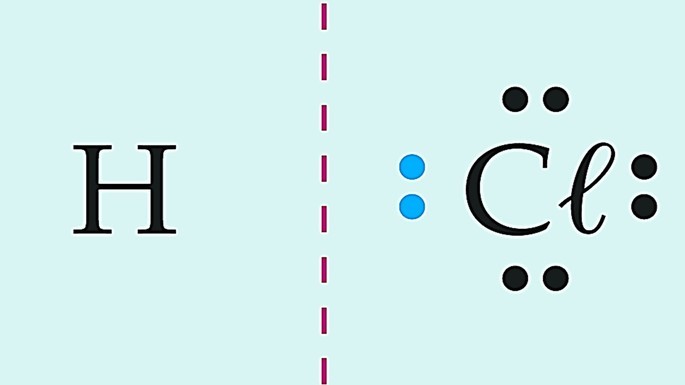
O ácido clorídrico é formado por elementos químicos diferentes e, por isso, a diferença de eletronegatividade é diferente de zero, que caracteriza uma ligação polar.
Saiba mais em: Eletronegatividade e Propriedades periódicas.
Polaridade da ligação iônica
Em uma ligação iônica é estabelecida a união dos átomos por meio da doação de elétrons e formam-se íons.
Quando um átomo doa elétrons, ele fica carregado positivamente e recebe o nome de cátion. O átomo que recebe os elétrons se torna uma espécie carregada com carga negativa e recebe o nome de ânion.
Nesse caso, a diferença de eletronegatividade ultrapassa o valor de 1,7 devido a forte atração de um dos átomos pelos elétrons, fazendo com que a ligação seja polar.
Veja esses exemplos:
| Substância | Eletronegatividade | Diferença de eletronegatividade |
|---|---|---|
| NaCl | ||
| KF |
Como um átomo cede elétrons e o outro recebe, formam-se polos no composto e, por isso, toda ligação iônica é polar.
Polaridade da ligação covalente
Em uma ligação covalente há o compartilhamento de elétrons na união de dois átomos em uma molécula.
A diferença de eletronegatividade entre átomos classifica as ligações covalentes em polar e apolar.
- Ligações covalentes apolares: estabelecida entre átomos de um mesmo elemento químico.
- Ligações covalentes polares: estabelecida entre elementos químicos diferentes, ou seja, que possuem eletronegatividades diferentes.
Veja esses exemplos:
| Substância | Eletronegatividade | Diferença de eletronegatividade |
|---|---|---|
| H2 | ||
| HBr |
Na molécula de hidrogênio a ligação é covalente apolar, pois como não há diferença de eletronegatividade os elétrons compartilhados ficam distribuídos igualmente entre os dois átomos.
O brometo de hidrogênio possui ligação covalente polar, já que é composto por elementos químicos diferentes e, por isso, o átomo mais eletronegativo exerce uma atração sobre os pares de elétrons compartilhados.
Saiba mais em: Ligação covalente e polaridade das moléculas.
Ligação iônica x ligação covalente
Observe essas substâncias formadas pelo cloro e diferentes elementos químicos.
| Substância | Diferença de eletronegatividade | Tipo de ligação |
|---|---|---|
 |
Covalente apolar | |
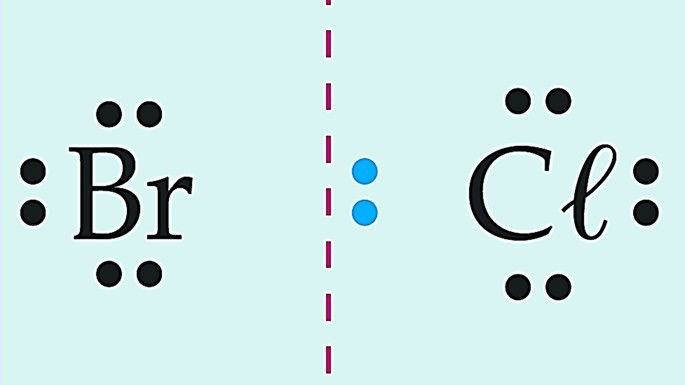 |
Covalente polar | |
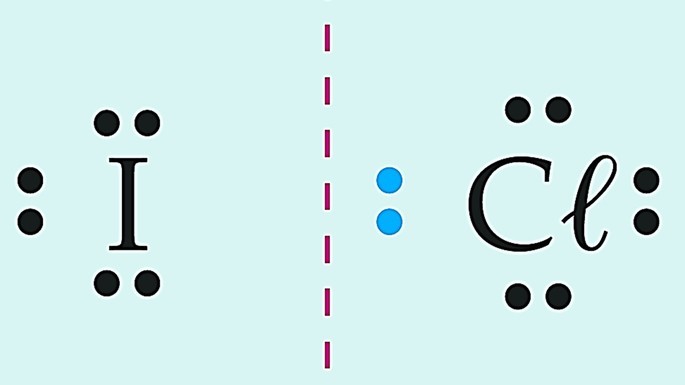 |
Covalente polar | |
 |
Covalente polar | |
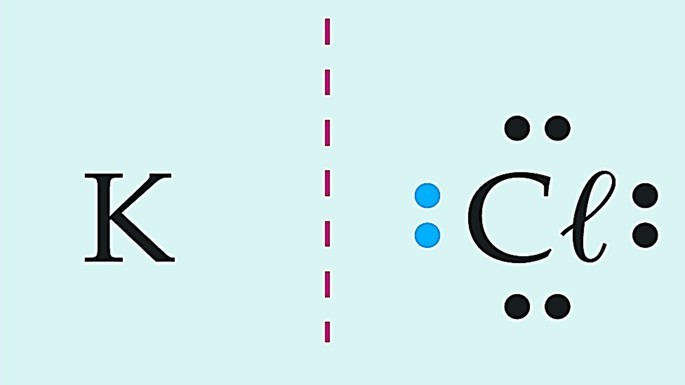 |
Iônica |
Quanto maior a diferença de eletronegatividade entre os átomos de um composto, os elétrons passam a ser atraídos pelo elemento mais eletronegativo.

A ligação iônica pode ser descrita como um caso extremo da ligação covalente polar, pois a diferença de eletronegatividade é tão grande que promove a transferência do elétron de um átomo para outro, ao invés de ocorrer o compartilhamento entre ambos.
Leia também:
Resumo sobre polaridade das ligações químicas
| Ligações | Covalentes | Apolares |
|
| Polares | |||
| Iônicas | Polares |
BATISTA, Carolina. Polaridade das ligações. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/polaridade-das-ligacoes/. Acesso em:



