O que é molécula?
Molécula é um conjunto de átomos, iguais ou diferentes, unidos por ligações covalentes.
Essas espécies químicas são eletricamente neutras e representam a unidade formadora de uma substância.
Existem moléculas simples, como o oxigênio (O2) do ar que respiramos. Entretanto, há também compostos complexos, como as buckyballs (60 átomos de carbono ligados em formato de esfera), que são as maiores moléculas já encontradas no espaço.
Estudo da molécula
A ligação covalente em uma molécula corresponde ao compartilhamento de elétrons, geralmente entre elementos não metálicos.
Veja a molécula de água como exemplo de um composto simples.
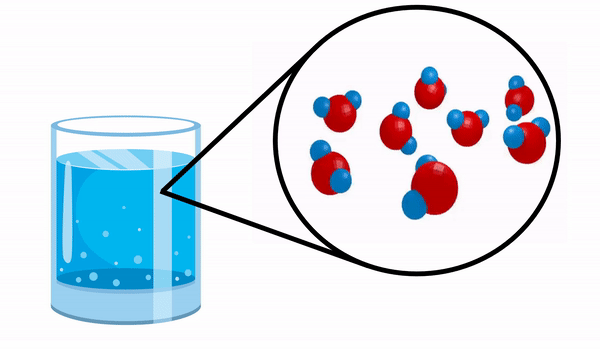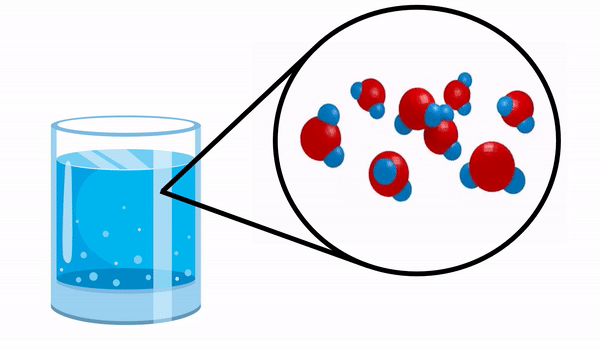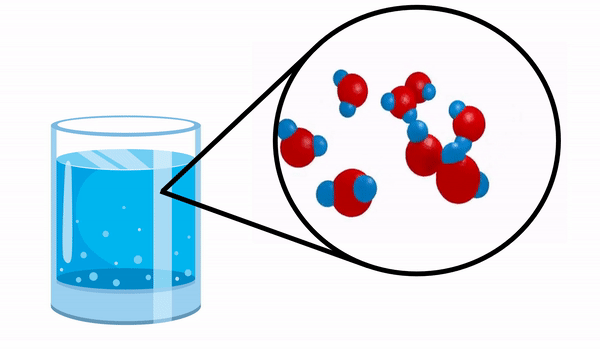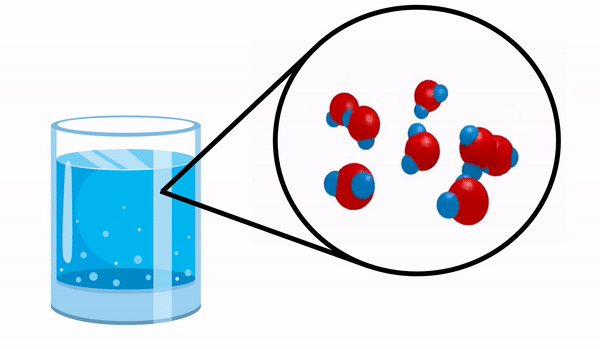
Ao observarmos um copo com água não temos ideia que essa substância é formada por várias moléculas de H2O. Essa fórmula indica que a água é composta por 3 átomos: dois átomos de hidrogênio e um de oxigênio, que estão compartilhando elétrons entre si.
O açúcar, que utilizamos para adoçar sucos e fazer bolos, é formado também por moléculas. A unidade formadora do açúcar é a sacarose.
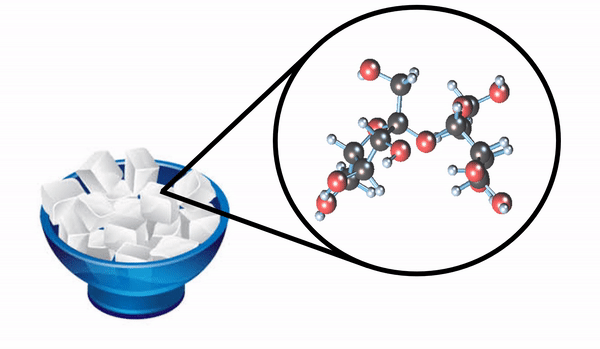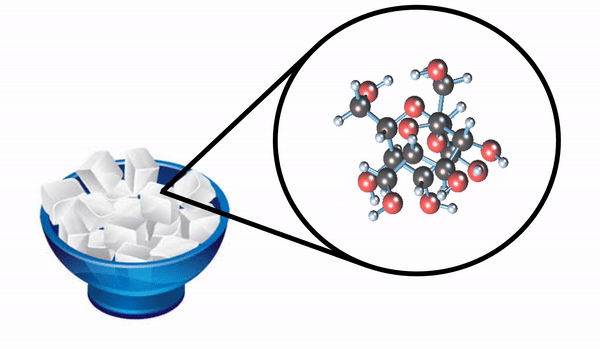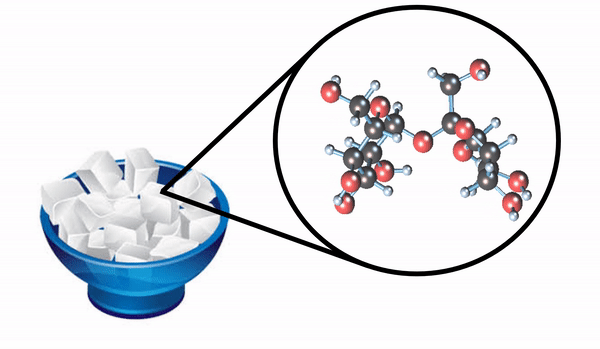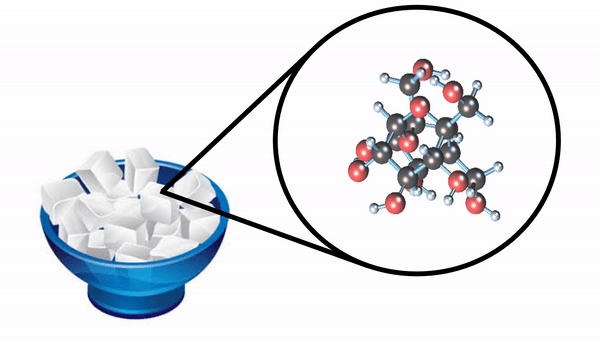
Essa molécula é bem mais complexa, pois são 45 átomos ligados. Ela é formada por: 12 átomos de carbono, 22 átomos de hidrogênio e 11 átomos de oxigênio.
As moléculas são estruturas de massa molecular conhecida, mas existem também as macromoléculas, que são "estruturas gigantes" formadas por tantos átomos que a sua composição chega a ser indefinida. Um exemplo desse tipo é o diamante, uma macromolécula formada por inúmeros átomos de carbono em uma rede covalente.
Ligação covalente
Uma ligação química covalente é estabelecida entre dois átomos quando estes compartilham seus elétrons mais externos (de valência). As moléculas podem ter dois tipos de ligações:
Ligação covalente molecular: ocorre o compartilhamento do par de elétrons dos dois átomos ligantes.
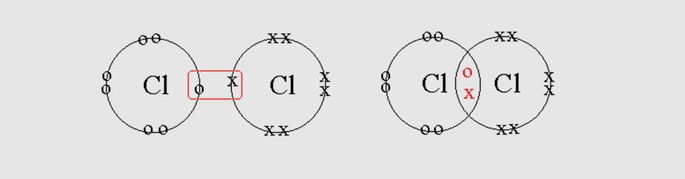
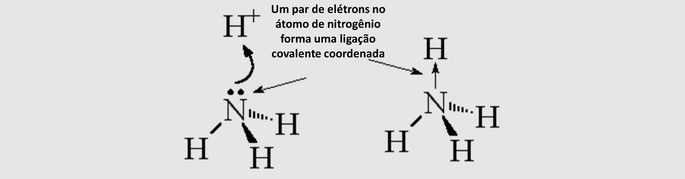
Ligação covalente coordenada (dativa): os elétrons compartilhados são provenientes de apenas um dos átomos envolvidos.
Geometria molecular
Quando se forma uma molécula os átomos se posicionam de diferentes maneiras, de modo que a disposição espacial seja mais estável. Por isso, os compostos apresentam diferentes geometrias.
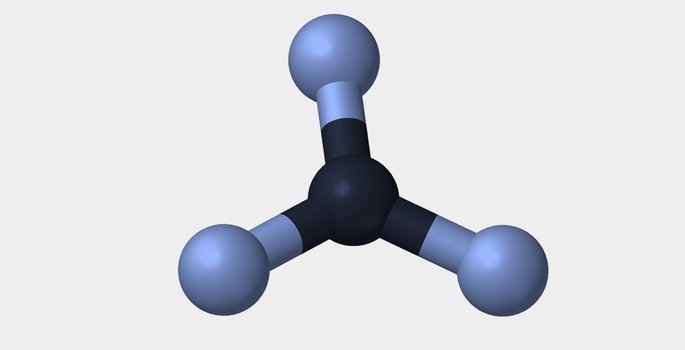
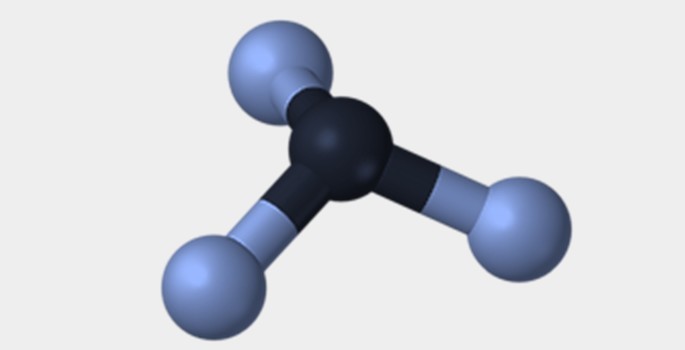
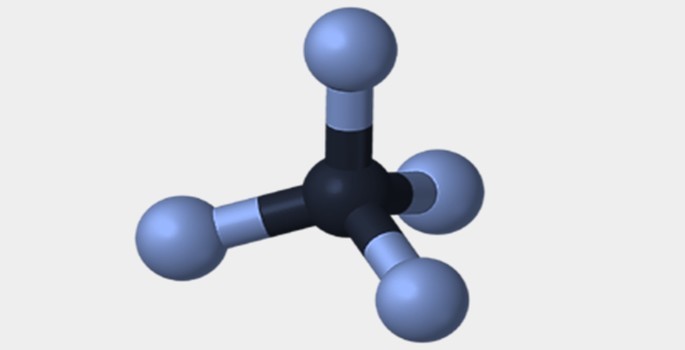
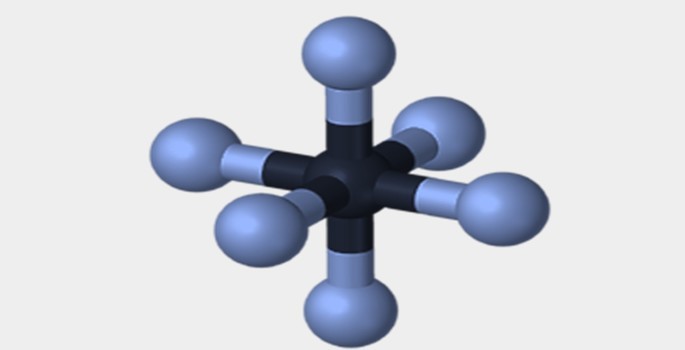
Veja a seguir algumas das geometrias que as moléculas podem apresentar.
| Geometria molecular | ||
|---|---|---|
| Linear | Angular | Triangular |
|
|
|
| Piramidal | Tetraédrica | Octaédrica |
|
|
|
Moléculas polares e apolares
As moléculas são classificadas de acordo com a polaridade.
Moléculas apolares: não existe diferença de eletronegatividade entre os átomos.
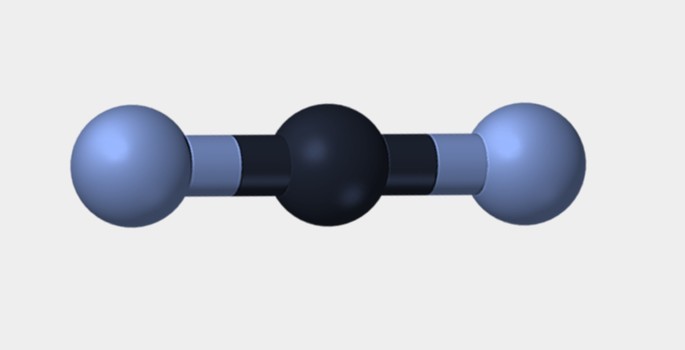
| Nitrogênio (N2) | Dióxido de carbono (CO2) |
|---|---|
 |
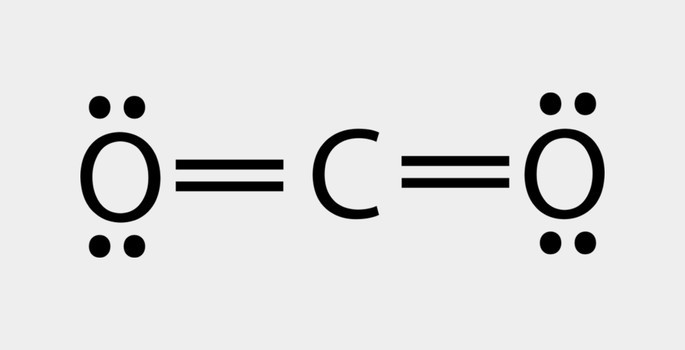 |
O nitrogênio (N2) é uma molécula apolar por ser formada pelo mesmo elemento químico e, por isso, não há diferença de eletronegatividade. O dióxido de carbono (CO2) é apolar devido à sua geometria linear, que estabiliza a atração do oxigênio pelos elétrons.
Moléculas polares: existe diferença de eletronegatividade entre os átomos, apresentando um polo positivo e outro polo negativo.
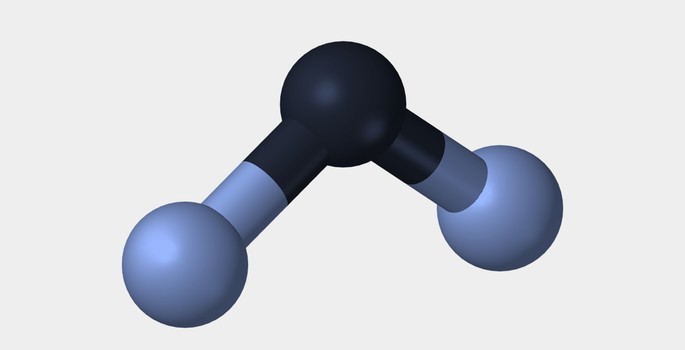
| Água (H2O) | Amônia (NH3) |
|---|---|
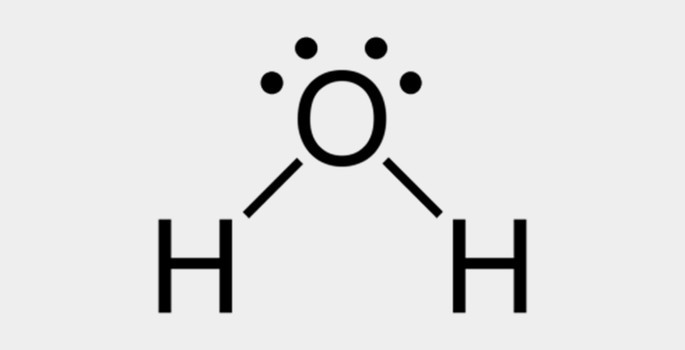 |
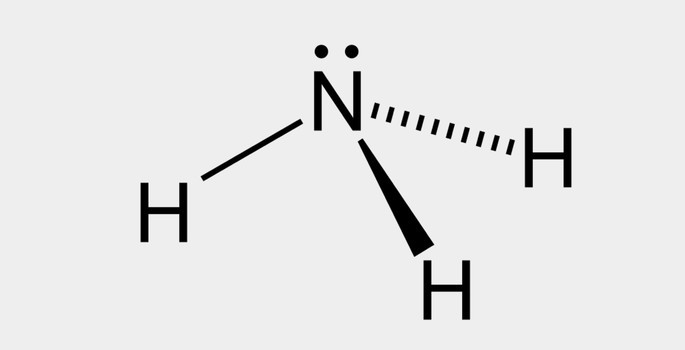 |
Nos dois exemplos, vemos que os átomos centrais, oxigênio e nitrogênio, possuem pares de elétrons desemparelhados que formam nuvens eletrônicas. Como há mais nuvens eletrônicas ao redor dos átomos centrais do que ligações químicas estabelecidas, as moléculas são polares.
Exemplos de moléculas
| Substância | Características | Molécula | Fórmula |
|---|---|---|---|
| Hidrogênio | Combustível e abundante na crosta terrestre. | 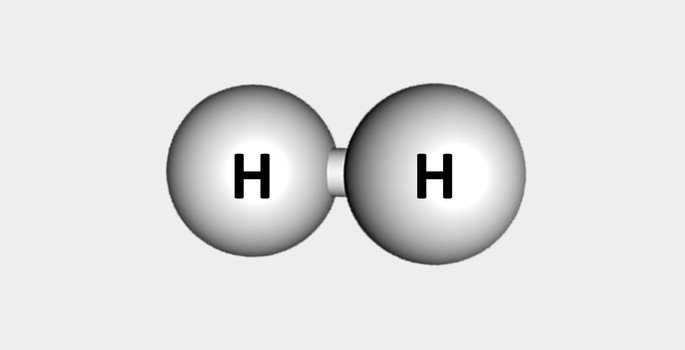 |
H2 |
| Oxigênio | Indispensável para respiração e participa de diversas reações químicas | 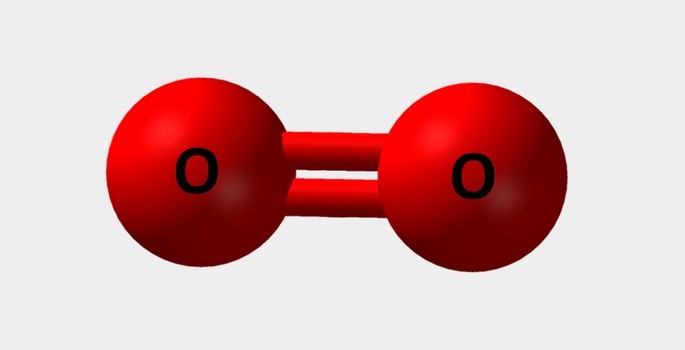 |
O2 |
| Enxofre | Pó amarelo utilizado para fabricar corantes. | 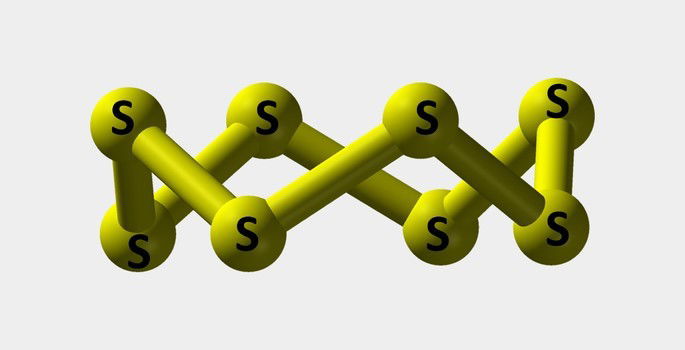 |
S8 |
| Dióxido de carbono | Utilizados em extintores e refrigerantes. | 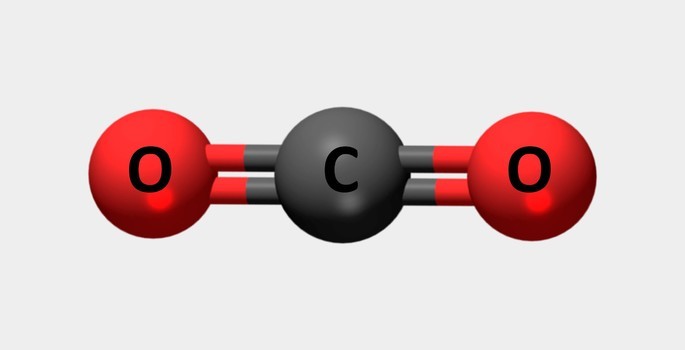 |
CO2 |
| Etanol | Álcool comum utilizado como combustível e em perfumes. | 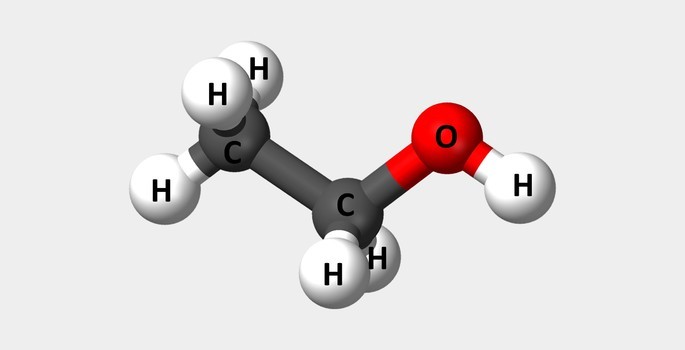 |
C2H6O |
Não deixe de conferir esses textos sobre assuntos relacionados ao que você acabou de aprender:
- Biomoléculas
- Compostos orgânicos
- Massa Molecular
- Regra do Octeto
- Ligações Químicas
- Polaridade das Ligações
- Forças Intermoleculares
BATISTA, Carolina. O que é molécula?. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/o-que-e-molecula/. Acesso em:


