Oxigênio (O): dados, características e importância
O oxigênio é um elemento químico de símbolo O e número atômico, ou seja, número de prótons igual a 8.
O oxigênio apresenta massa atômica 15,999 u e na eletrosfera do átomo estão 8 elétrons. Por isso, sua distribuição eletrônica é 1s2 2s2 2p4 e a camada de valência contém 6 elétrons (2 + 4).
Trata-se do elemento mais abundante da superfície da Terra e o terceiro do Universo, que pode ser encontrado na forma livre ou combinado com outras substâncias, como a água (H2O).
O gás oxigênio, que apresenta fórmula O2, está presente na atmosfera terrestre e é indispensável à vida, pois praticamente todos os seres vivos o utilizam na respiração. Além disso, essa substância também participa do processo de fotossíntese.
Como o corpo humano é formado majoritariamente por água, cerca de 2/3 da composição da sua composição apresenta esse elemento.
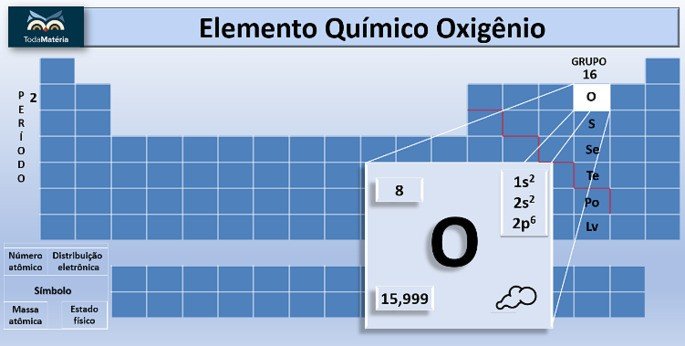
Na tabela periódica o oxigênio está localizado no segundo período e faz parte da família dos calcogênios, junto com enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e livermório (Lv), que foram reunidos no grupo 16 por apresentarem propriedades semelhantes.
A descoberta do elemento químico ocorreu através de experimentos realizados pelos cientistas Joseph Priestley e Carl Wilhelm Scheele. Já o seu nome foi atribuído pelo químico francês Antoine Lavoisier.
Características do oxigênio
O oxigênio é um ametal e possui a tendência de ganhar elétrons. Por apresentar seis elétrons na camada de valência, pela Regra do Octeto, o oxigênio precisa receber dois elétrons para tornar-se estável. Logo, um átomo de oxigênio precisa realizar duas ligações químicas.
Por exemplo, no gás oxigênio os dois átomos são unidos por uma ligação covalente dupla. Já na molécula de água dois átomos de oxigênio realizam uma ligação covalente simples com um átomo de hidrogênio.
O átomo de oxigênio apresenta alta eletronegatividade, ou seja, grande capacidade de atrair elétrons, sendo a segunda maior da tabela periódica, atrás apenas do Cloro (Cl).
A massa atômica do oxigênio é de aproximadamente 16 u. A sua massa molar é 16 g/mol e massa molar do gás oxigênio, formado por dois átomos de oxigênio, é 32 g/mol.
Leia também:Distribuição Eletrônica.
Formas alotrópicas
A alotropia é uma propriedade dos elementos químicos de formar duas ou mais substâncias simples diferentes.
As formas alotrópicas do oxigênio são: o gás oxigênio e o gás ozônio. A diferença entre eles é de apenas um átomo. Apesar de parecer sutil, essa condição faz com que os dois gases apresentem características distintas um do outro.
Gás Oxigênio (O2)
O gás oxigênio constitui 20,8% da atmosfera. Ele é fundamental para existência da vida por causa da respiração e por compor moléculas importantes.
Principais características do gás oxigênio:
- Formado pela união de dois átomos de oxigênio;
- Encontrado na forma de gás em temperatura ambiente;
- Gás inodoro e incolor;
- O gás oxigênio líquido é de cor azul;
- Ponto de Fusão: - 218,4 °C;
- Ponto de Ebulição: - 182,8 °C.
Gás Ozônio (O3)
O gás ozônio possui a função de absorver os raios ultravioletas do Sol, o que constitui a camada de ozônio.
Apesar desse benefício, quando é encontrado próximo da superfície terrestre é um gás poluente e tóxico para os seres vivos.
Principais características do gás ozônio:
- Formado pela união de três átomos de oxigênio;
- Gás de cor azul claro e odor forte;
- Instável, não consegue manter sua estrutura de três átomos por muito tempo;
- Bastante reativo;
- Ponto de fusão: - 249,4 °C;
- Ponto de ebulição: - 111,3 °C.
Isótopos do oxigênio
O oxigênio apresenta três isótopos naturais. Os isótopos apresentam o mesmo número de prótons e diferenciam-se pelo número de nêutrons e massa. No caso do oxigênio, todos possuem 8 prótons.
Oxigênio-16 : possui 8 nêutrons, sendo o mais abundante (99,76%) e estável da natureza.
Oxigênio- 17 : possui 9 nêutrons e sua ocorrência é de 0,04 % entre os isótopos na natureza.
Oxigênio-18 : possui 10 nêutrons e sua ocorrência é de 0,2 % entre os isótopos na natureza.
Ciclo do Oxigênio
O ciclo do oxigênio corresponde ao movimento e transformação desse elemento entre os seus reservatórios naturais: atmosfera, biosfera e litosfera. O que acontece através da ação biológica, física, geológica e hidrológica.
A principal fonte de produção do oxigênio na atmosfera é devido à ação fotossintetizante do fitoplâncton.
O gás oxigênio é usado por animais e plantas em suas respirações aeróbias. Após isso, ocorre a produção de CO2, H2O e energia.
O oxigênio também é encontrado na forma do gás ozônio formando a camada de protege a Terra dos raios ultravioletas do Sol.
Leia também sobre:
Referências Bibliográficas
ATKINS, P.W.; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006.
FELTRE, Ricardo. Fundamentos de Química: vol. único. 4ª.ed. São Paulo: Moderna, 2005.
Lee, J. D. Química inorgânica não tão concisa. Tradução da 5ª ed. inglesa. Editora Edgard Blücher Ltda. 1999.
BATISTA, Carolina. Oxigênio (O): dados, características e importância. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/oxigenio/. Acesso em:



