Regra do Octeto
A Regra do Octeto ou Teoria do Octeto estabelece que os átomos devem possuir oito elétrons em sua camada de valência de modo a adquirir estabilidade química. Entenda camada de valência como sendo a última camada eletrônica de um átomo.
A regra do octeto diz que:
em uma ligação química um átomo tende a ficar com oito elétrons em sua camada de valência no estado fundamental, semelhante a um gás nobre.
Para que os átomos apresentem a camada de valência completa é preciso realizar ligações químicas com objetivo de doar, receber ou compartilhar elétrons.
Os átomos tendem a compartilhar elétrons até adquirir uma configuração estável, ou seja, a camada de valência completa.
Desse modo, um átomo apresenta a distribuição eletrônica igual a de um gás nobre mais próximo ao seu número atômico.
Os gases nobres (Família 8A) são os elementos da tabela periódica que possuem oito elétrons na camada de valência. A única exceção é o elemento Hélio que possui 2 elétrons.
Quando o átomo possui oito elétrons na camada de valência, ele alcança a sua estabilidade. Isso quer dizer que não se ligará a outros átomos, pois não apresenta tendência a ganhar ou perder elétrons.
É por isso que não encontramos compostos formados por gases nobres.
Exemplos
Confira alguns exemplos de ligações químicas realizadas com o objetivo de alcançar os oito elétrons na camada de valência:
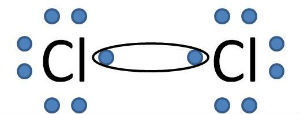
Cloro
O Cloro (Cl) possui número atômico 17 e sete elétrons na camada de valência. Assim, para que ele se torne estável precisa de um elétron.
Por isso, ele precisa compartilhar um par de elétrons através de ligações químicas. Uma forma é ligar-se com outro átomo de Cloro e formar a molécula Cl2.
Assim, ambos os átomos, completam os oito elétrons na camada de valência, satisfazendo a regra do octeto.
Oxigênio
O oxigênio possui seis elétrons na camada de valência. Para torna-se estável, ele precisa de mais dois elétrons que serão obtidos através de ligações químicas.
O oxigênio pode ligar-se com dois átomos de hidrogênio e formar uma molécula de água. Essa é uma ligação covalente, e cada hidrogênio compartilha um de seus elétrons.
Assim, o oxigênio passa a ter oito elétrons na camada de valência.
Para saber mais sobre as ligações químicas, leia também:
Exceções
Como em toda regra, existem as suas exceções. As exceções a regra do octeto abrange os elementos que não precisam de oito elétrons na camada de valência para serem estáveis.
Confira alguns casos de exceções a regra do octeto:
Os elementos estáveis com menos de oito elétrons
Também chamada de contração do octeto, é mais comum de acontecer com elementos do segundo período da tabela periódica.
Incluem-se nessa exceção os elementos que, com menos de oito elétrons na camada de valência, tornam-se estáveis.
Um exemplo é o elemento Berílio (Be), ele torna-se estável com apenas quatro elétrons na última camada.
O Boro (B) e Alumínio (Al) tornam-se estáveis com seis elétrons na camada de valência.
Os elementos estáveis com mais de oito elétrons
Também chamada de expansão do octeto, acontece com elementos não metálicos a partir do terceiro período. Pelo fato de possuírem mais camadas eletrônicas, eles possuem também mais orbitais disponíveis para receber elétrons.
Essa situação ocorre com o Fósforo (P) e o Enxofre (S). O fósforo pode receber até 10 elétrons e o enxofre 12 elétrons.
Leia também:
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005, 671p.
MAGALHÃES, Lana. Regra do Octeto. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/regra-do-octeto/. Acesso em:



