Eletropositividade
Eletropositividade é uma propriedade periódica que indica a tendência de um átomo perder elétrons numa ligação química.
A partir dessa perda, são formados cátions. Os cátions são íons (átomos eletrizados) que têm mais prótons do que elétrons, logo, apresentam carga positiva.
Como a Eletropositividade varia na Tabela Periódica?
O aumento ou redução da eletropositividade nos elementos químicos acontece no mesmo sentido que o do raio atômico.
Se o número atômico é grande, o átomo tem mais camadas. Dessa forma, os elétrons ficam mais distantes do seu núcleo, o que faz com que a carga negativa se afaste dele.
A eletropositividade é baixa nos elementos constantes no nível superior da tabela periódica. Ela aumenta nos grupos quanto mais posicionados à esquerda eles estiverem.
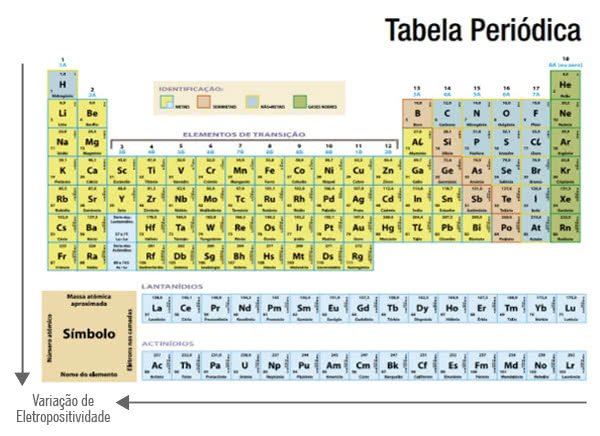
Assim, a eletropositividade aumenta nos elementos que têm raios maiores. Frâncio, Césio e Rubídio são mais eletropositivos do que Flúor, Oxigênio e Nitrogênio.
Por esse motivo é que a eletropositividade também é conhecida como caráter metálico. Os metais são os elementos mais eletropositivos.
Eletropositividade x Eletronegatividade
O nome eletronegatividade sugere justamente o oposto da eletropositividade.
Ambas são propriedades periódicas. Mas, enquanto a eletropositividade expulsa elétrons aumentando a sua carga positiva, a eletronegatividade atrai elétrons aumentando a sua carga negativa.
Decorre que ao passo que os metais apresentam uma carga positiva maior, os ametais ou não metais são os que têm a menor carga positiva.
O que é Afinidade Eletrônica?
A afinidade eletrônica é mais uma propriedade periódica. Trata-se da energia liberada no momento em que um átomo recebe um elétron.
Há 5 propriedades periódicas. Além das já citadas (afinidade eletrônica, eletropositividade, eletronegatividade), as outras são: potencial de ionização e raio atômico.
Leia também:
Eletropositividade. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/eletropositividade/. Acesso em:

