Polaridade das moléculas
De acordo com a polaridade, as moléculas são classificadas em polares e apolares.
Ao submeter uma molécula a um campo elétrico (polos positivo e negativo) e ocorrer uma atração devido às cargas, essa molécula é considerada polar. Quando não há orientação em direção ao campo elétrico, trata-se de uma molécula apolar.
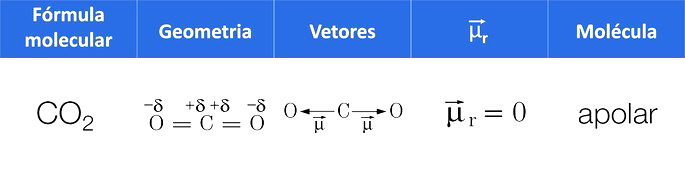
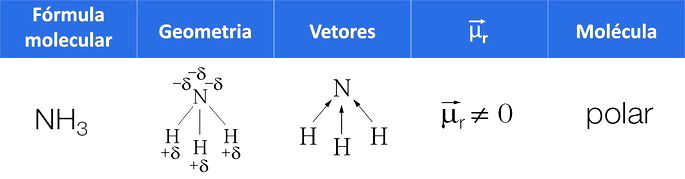
Outra maneira de identificar a polaridade é através da soma dos vetores de cada ligação polar da molécula, pois em uma molécula apolar, o momento dipolar resultante () é igual a zero. Quando
é diferente de zero, a molécula é polar.
De maneira geral, dois fatores influenciam a polaridade das moléculas: a eletronegatividade dos átomos e a geometria molecular.
Eletronegatividade dos átomos
A capacidade de um átomo atrair para si os elétrons compartilhados com outro átomo em uma ligação covalente é chamada de eletronegatividade.
Veja o que acontece na formação do cloreto de hidrogênio:

De acordo com valores de eletronegatividade atribuídos ao hidrogênio e cloro, esses são, respectivamente, 2,20 e 3,16. O cloro apresenta maior eletronegatividade e, por isso, atrai o par de elétrons da ligação para si, provocando um desequilíbrio de cargas.
A molécula de HCl (ácido clorídrico) é polar, porque se forma um polo negativo no cloro devido ao acúmulo de carga negativa e, consequentemente, o lado do hidrogênio tende a ficar com carga positiva acumulada, formando um polo positivo.
O mesmo ocorre com o HF (ácido fluorídrico), HI (ácido iodídrico) e o HBr (ácido bromídrico), que são moléculas diatômicas, cujos átomos possuem eletronegatividades diferentes.
Moléculas apolares
Quando uma molécula é formada por apenas um tipo de elemento químico, não há diferença de eletronegatividade, sendo assim, não se formam polos e a molécula é classificada como apolar, independente de sua geometria.
Exemplos:
| Moléculas apolares | Estrutura |
|---|---|
| Hidrogênio, H2 |  |
| Nitrogênio, N2 |  |
| Fósforo, P4 |  |
| Enxofre, S8 |  |
Uma exceção a essa regra é a molécula de ozônio, O3.

Embora seja formada apenas por átomos de oxigênio, sua geometria angular apresenta pequena polaridade devido à ressonância entre os pares de elétrons emparelhados e livres na molécula.
Geometria molecular
As ligações covalentes polares são formadas pelo compartilhamento desigual de elétrons entre os átomos ligantes.
Entretanto, não só a presença desse tipo de ligação faz com que uma molécula seja polar. É necessário levar em consideração a maneira como os átomos se organizam para formar a estrutura.
Quando há diferença de eletronegatividade entre os átomos, a geometria determina se a molécula é polar ou apolar.
| Molécula | Estrutura | Geometria | Polaridade |
|---|---|---|---|
| Dióxido de carbono, CO2 |  |
Linear | Apolar |
| Água, H2O | 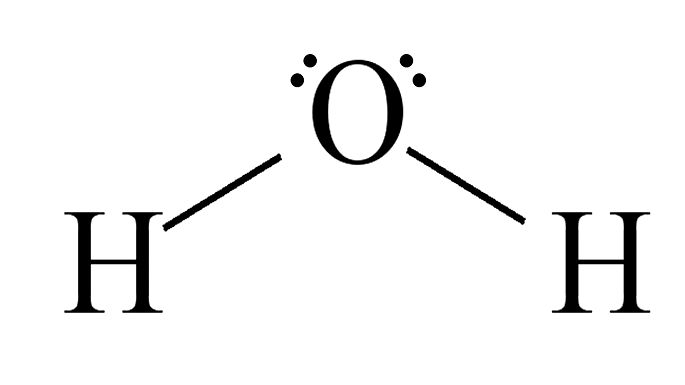 |
Angular | Polar |
O dióxido de carbono é apolar devido à geometria linear que faz com que o momento dipolar resultante da molécula seja igual a zero. Em contrapartida, a água com sua geometria angular faz com que a molécula seja polar devido o vetor do momento dipolar ser diferente de zero.
Momento dipolar
Os polos de uma molécula referem-se à carga parcial, representada por , visto que os elétrons são compartilhados e não transferidos de um átomo para outro.
A polaridade de uma molécula com mais de dois átomos é determinada pelo (vetor momento dipolar resultante), em que são somados os vetores de cada ligação polar da molécula. Quando o resultado é nulo, a molécula é apolar e, caso contrário, polar.
Exemplo 1: Molécula de dióxido de carbono, CO2.
| Elemento | Eletronegatividade |
|---|---|
| Carbono | 2,55 |
| Oxigênio | 3,44 |
O CO2 tem duas ligações polares, pois o oxigênio é mais eletronegativo que o carbono.
Como a molécula é linear, a atração eletrônica do oxigênio “da esquerda” é contrabalançada pela atração do oxigênio “da direita” e, como resultado, temos uma molécula apolar.

Em outras palavras, o momento dipolar resultante é nulo, pois os vetores possuem:
- mesma intensidade (ligações iguais).
- mesma direção.
- sentidos contrários.
Exemplo 2: Molécula de água, H2O.
| Elemento | Eletronegatividade |
|---|---|
| Hidrogênio | 2,20 |
| Oxigênio | 3,44 |
A água tem duas ligações polares, pois o oxigênio é mais eletronegativo que o hidrogênio.
Na geometria angular da água, o lado dos hidrogênios é eletropositivo, e o oxigênio, eletronegativo.

Como os vetores não se cancelam, o vetor resultante é diferente de zero, caracterizando uma molécula polar.
Exercício com gabarito comentado
1. (Unesp) O efeito estufa resulta principalmente da absorção da radiação infravermelha, proveniente da radiação solar, por moléculas presentes na atmosfera terrestre. A energia absorvida é armazenada na forma de energia de vibração das moléculas. Uma das condições para que uma molécula seja capaz de absorver radiação infravermelha é que ela seja polar. Com base apenas nesse critério, entre as moléculas O2, N2 e H2O, geralmente presentes na atmosfera terrestre, contribuem para o efeito estufa:
a) O2, apenas.
b) H2O, apenas.
c) O2 e N2, apenas.
d) H2O e N2, apenas.
e) N2, apenas.
Adquira mais conhecimento lendo os textos a seguir:
2. (Ufes) A molécula do OF2 é polar, e a molécula do BeF2 é não polar. Isto se deve à (ao):
a) diferença de eletronegatividade entre os átomos nas respectivas moléculas.
b) geometria molecular.
c) tamanho dos átomos ligados ao flúor.
d) grande reatividade do oxigênio em relação ao flúor.
e) fato de o oxigênio e o flúor serem gases.
3. (UFSC) Considere a tabela a seguir e selecione a(s) proposição(ões) que relaciona(m) corretamente a geometria e a polaridade das substâncias citadas:
| Fórmula | CO2 | H2O | NH3 | CCl4 |
|---|---|---|---|---|
| Momento dipolar resultante, |
| Substância | Geometria | Polaridade | |
|---|---|---|---|
| 01 | H2O | angular | polar |
| 02 | CO2 | linear | apolar |
| 04 | CCl4 | trigonal | polar |
| 08 | NH3 | piramidal | polar |
| 16 | CCl4 | tetraédrica | apolar |
Saiba mais em:
BATISTA, Carolina. Polaridade das moléculas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/polaridade-das-moleculas/. Acesso em: