Ácido sulfúrico
O ácido sulfúrico é um ácido mineral considerado forte, cuja fórmula molecular é H2SO4.
Essa substância inorgânica é de suma importância para a indústria química, sendo empregada na fabricação de inúmeros materiais e, por isso, seu consumo pode indicar o índice de desenvolvimento econômico de um país.
Fórmula do ácido sulfúrico
Na fórmula molecular do ácido sulfúrico, H2SO4, percebemos que ele é composto pelos elementos hidrogênio, oxigênio e enxofre. Estes átomos são unidos por ligações covalentes formando uma estrutura tetraédrica.
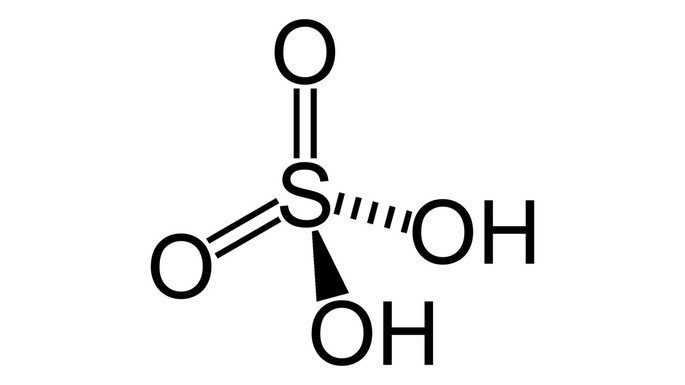
O ácido sulfúrico é classificado como diácido, pois possui dois hidrogênios ionizáveis. Por ser um ácido forte, ele tem facilidade de ionizar-se, conforme a equação química:
Observe que a fórmula geral de um ácido é HxA, onde H é o hidrogênio e x é o seu número de átomos. Já o A corresponde ao ânion, que no ácido sulfúrico é o sulfato ().
Saiba mais sobre os ácidos.
Características do ácido sulfúrico
O ácido sulfúrico é um líquido incolor, inodoro e de aspecto viscoso, que é considerado forte por seu grau de ionização ser maior que 50% na temperatura de 18º C.
Trata-se de uma substância não inflamável, muito corrosiva, oxidante, pouco volátil e higroscópica, ou seja, que absorve facilmente a água no ambiente.
Cuidado! O ácido sulfúrico é um composto químico que deve ser manuseado com precaução e utilizando equipamentos de proteção. Em contato com a pele pode causar queimaduras severas, gerando a destruição dos tecidos, e se inalado pode provocar danos às vias respiratórias.
Propriedades do ácido sulfúrico
As principais propriedades físicas são:
- Densidade: 1,84 g/cm3
- Ponto de fusão: 10,38 ºC
- Ponto de ebulição: 337 ºC
- Viscosidade: 26,7 cP
As principais propriedades químicas são:
- pH: ácido
- Massa molecular: 98,08 g/mol
- Grau de ionização: 61 %
- Reatividade: reage violentamente com água
Você sabia? A dissolução de ácido sulfúrico em água é exotérmica e libera uma grande quantidade de energia. Por isso, a forma correta de manuseá-lo é adicionar o ácido à água e nunca ao contrário, pois o ácido pode se projetar para fora do recipiente e causar danos.
Aplicações do ácido sulfúrico
A maior aplicação do ácido sulfúrico é para produção de fertilizantes, sendo empregado mais da metade da produção mundial do composto. No Brasil, por exemplo, aproximadamente 80% de H2SO4 é destinado para esta finalidade.
O ácido sulfúrico é a matéria-prima dos fertilizantes fosfatados, para fabricação de ácido fosfórico, mas também na síntese de sulfato de amônio.
Além dos fertilizantes, o ácido sulfúrico é consumido para tratamento de água, processamento de minérios e como reagente na síntese de outros materiais.
O ácido sulfúrico é um forte oxidante e reage facilmente com a água. Por isso, em concentrações maiores que 90%, é utilizado como agente desidratante.
O ácido sulfúrico também está presente nos acumuladores de automóveis, baterias de chumbo, formados por um ânodo e um cátodo, e a solução de ácido sulfúrico como eletrólito.
Trata-se de um insumo consumido também por diferentes ramos industriais, sendo alguns deles: tintas, papel, explosivos, refino de petróleo, medicamentos, entres outros.
Produção do ácido sulfúrico
O processo de obtenção do ácido sulfúrico pode ser dividido em três etapas, são elas:
1ª etapa: obtenção do SO2
O dióxido de enxofre (SO2) é fabricado em um processo chamado de ustulação, pela queima do minério pirita, FeS2(s), em fornos especiais, produzindo a seguinte equação:
Com a reação obtém-se um rendimento de 14%. Outras matérias-primas, para fabricação em menor escala, são: S8(s) (enxofre natura), ZnS(s) (sulfeto de zinco) e CaSO4 (sulfato de cálcio).
2ª etapa: conversão de SO2 em SO3
O dióxido de enxofre (SO2) da etapa anterior é oxidado a trióxido de enxofre (SO3) em temperatura de 450 ºC.
Nesta etapa, platina metálica, Pt(s), ou o pentóxido de divanádio, V2O5(s) são empregados como catalisadores, para acelerar o processo de conversão.
3ª etapa: reação do SO3 com H2O
Finalmente, a dissolução do trióxido de enxofre em água forma o ácido sulfúrico.
A concentração obtida de H2SO4(aq) é de até 98%.
Complemente seus estudos lendo também sobre:
BATISTA, Carolina. Ácido sulfúrico. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/acido-sulfurico/. Acesso em:



