Ácidos e Bases
Ácidos e bases são dois grupos químicos relacionados entre si. São duas substâncias de grande importância e presentes no cotidiano.
Os ácidos e bases são estudados pela Química Inorgânica, o ramo que estuda os compostos que não são formados por carbono.
Conceitos de ácidos e bases
O conceito de Arrhenius
Um dos primeiros conceitos de ácidos e bases desenvolvido no final do século XIX, por Svante Arrhenius, um químico sueco.
Segundo Arrhenius, os ácidos são substâncias que em solução aquosa sofrem ionização, liberando cátions, no caso o H+.
HCl (aq) → H+ (aq) + Cl-(aq)
Enquanto isso, as bases são substâncias que sofrem dissociação iônica, liberando o ânion os íons OH-, ou seja, hidroxilas.
NaOH (aq) → Na+ (aq)+ OH-(aq)
Entretanto, o conceito de Arrhenius para ácidos e bases mostrou-se restrito a água.
O Conceito de Bronsted-Lowry
O conceito de Bronsted-Lowry é mais abrangente do que o de Arrhenius e foi apresentado em 1923.
De acordo essa nova definição, os ácidos são substâncias capazes de doar um próton H+ a outras substâncias. As bases, por outro lado, são substâncias capazes de aceitar um próton H+ de outras substâncias.
Ou seja, o ácido é doador de prótons e a base é receptora de prótons. Para ficar claro, o hidrogênio é chamado de próton na condição de H+, pois não há elétron em seu orbital, assim ele só possui o próton no seu núcleo.
Caracteriza-se um ácido forte como aquele que se ioniza completamente na água, isto é, libera íons H+.
Porém, as substâncias podem ser anfiprótica, ou seja, capaz de se comportar como um ácido ou base de Bronsted.
Observe o exemplo da água (H2O), uma substância anfiprótica:
HNO3(aq) + H2O(l) → NO3- (aq) + H3O+(aq) = Base de Bronsted, aceitou o próton
NH3(aq) + H2O(l) → NH4+(aq) + OH-(aq) = Ácido de Bronsted, doou o próton
Além disso, as substâncias se comportam como pares conjugados. Todas as reações entre um ácido e uma base de Bronsted envolvem a transferência de um próton e tem dois pares ácido-base conjugados. Veja o exemplo:
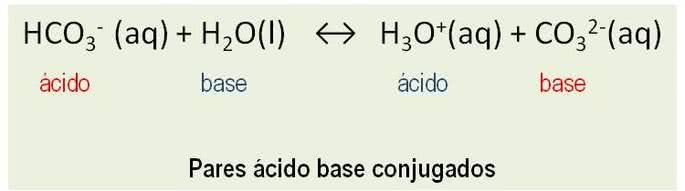
HCO3- e CO32-; H2O e H3O+ são pares ácido-base conjugados.
Aprenda mais sobre:
- Ácidos: o que são, suas características e tipos (com exemplos)
- Bases
- Funções Inorgânicas: Ácidos, Bases, Sais e Óxidos
Nomenclatura de ácidos
Para definir a nomenclatura, os ácidos são divididos em dois grupos:
- Hidrácidos: ácidos sem oxigênio;
- Oxiácidos: ácidos com oxigênio.
Hidrácidos
A nomenclatura ocorre da seguinte forma:
ácido + nome do elemento + ídrico
Exemplos:
HCl = ácido clorídrico
HI = ácido iodídrico
HF = ácido fluorídrico
Oxiácidos
A nomenclatura dos oxiácidos segue as seguintes regras:
Os ácidos-padrões de cada família (famílias 14, 15, 16 e 17 da Tabela Periódica) seguem a regra geral:
ácido + nome do elemento + ico
Exemplos:
HClO3 = ácido clórico
H2SO4 = ácido sulfúrico
H2CO3: ácido carbônico
Para os outros ácidos que se formam com um mesmo elemento central, nomeamos com base na quantidade de oxigênio, seguindo a seguinte regra:
| Quantidade de oxigênio, em relação ao ácido-padrão | Nomenclatura |
|---|---|
| + 1 oxigênio | Ácido + per + nome do elemento + ico |
| - 1 oxigênio | Ácido + nome do elemento + oso |
| - 2 oxigênios | Ácido + hipo + nome do elemento + oso |
Exemplos:
HClO4 (4 átomos de oxigênio, um a mais que o ácido-padrão) : ácido perclórico;
HClO2 (2 átomos de oxigênio, um a menos que o ácido padrão): ácido cloroso;
HClO (1 átomo de oxigênio, dois a menos que o ácido padrão): ácido hipocloroso.
Você também pode se interessar por Nomenclatura dos ácidos.
Nomenclatura de Bases
Para nomenclatura de bases segue-se a regra geral:
Hidróxido de + nome do cátion
Exemplo:
NaOH = Hidróxido de sódio
Porém, quando um mesmo elemento forma cátions com diferentes cargas acrescenta-se ao final do nome, em algarismos romanos, o número da carga do íon.
Ou, pode-se acrescentar o sufixo - oso, ao íon de menor carga e o sufixo -ico, ao íon de maior carga.
Exemplo:
Ferro
Fe2+ = Fe(OH)2 = Hidróxido de ferro II ou Hidróxido ferroso;
Fe3+ = Fe(OH)3 = Hidróxido de ferro III ou Hidróxido férrico.
Não deixe de conferir questões de vestibulares sobre o tema, com resolução comentada, em:
CASTILHO, Rubens. Ácidos e Bases. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/acidos-e-bases/. Acesso em:


