Nomenclatura dos ácidos: entenda as regras e suas aplicações
Na química é comum existir regras e padrões para aplicação de nomenclaturas às fórmulas. Dessa maneira, após uma reação química será possível prever o seu produto e nomeá-lo segundo os tipos de reagentes envolvidos na reação.
Assim, quaisquer substâncias, incluindo os ácidos, são nomeadas.
De maneira geral, existem os ácidos que não possuem oxigênio, chamados de hidrácidos, e os ácidos com oxigênio, os oxiácidos.
Para nomear os hidrácidos basta seguir a regra geral: ácido + nome do elemento central + o sufixo ídrico. Para os oxiácidos segue o princípio: ácido + nome do elemento central + o sufixo ico ou oso.
Nomeando os ácidos
Os ácidos são substâncias inorgânicas capazes de doar prótons (H+) para outras substâncias. Pode parecer estranho, a primeira vista, pensar na doação de prótons. Contudo, o H+ é assim chamado, pois não há elétron orbitando ao redor do seu núcleo. Ou seja, há somente o próton no interior do núcleo, por isso, recebe esse nome.
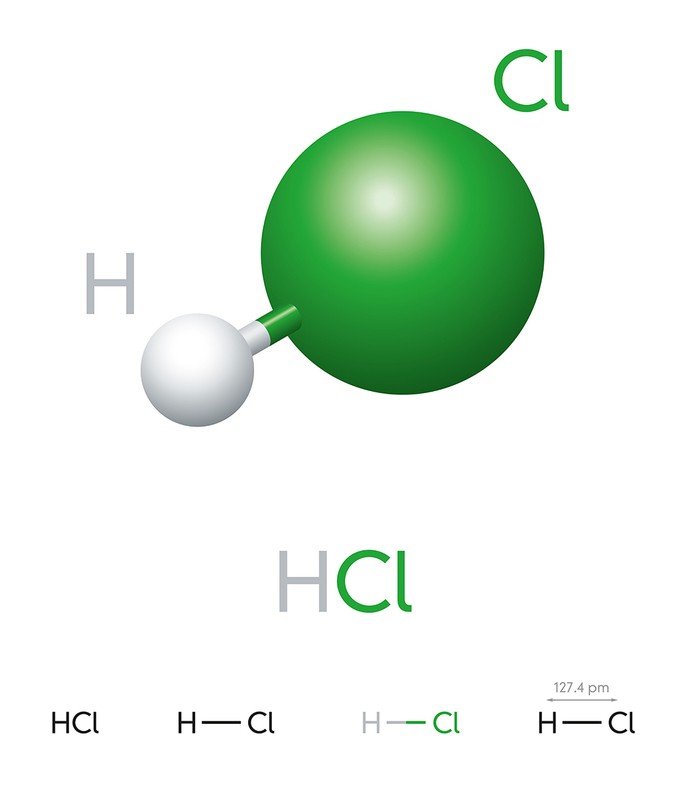
Para nomear os ácidos é necessário entender algumas regras. Para os hidrácidos, ácidos sem oxigênio, ela é bem simples. Por exemplo, o HCl não tem oxigênio, portanto, seu nome fica assim:
- Ácido clorídrico - ou seja, o cloro é o elemento central, e por ser um hidrácido recebe apenas o sufixo ídrico.
Logo, temos a seguinte regra:

Outros exemplos são:
- HBr: Ácido bromídrico;
- HCN: Ácido cianídrico;
- HF: Ácido fluorídrico;
- H2S: Ácido sulfídrico;
- HI: Ácido iodídrico.
Para os oxiácidos a quantidade de oxigênio vai definir a escolha do sufixo. Para moléculas com menor quantidade de oxigênio, ou seja, com menor oxigenação, será usado o sufixo oso. Para moléculas com maior oxigenação será utilizado o sufixo ico.
Observe o caso abaixo:
H2SO3 e o H2SO4 são moléculas muito parecidas, o que muda é justamente a quantidade de oxigênio. Na primeira há três, na segunda quatro. Dessa maneira, para nomear o primeiro usa-se o sufixo oso, na segunda o sufixo ico.
Assim, as regras são:
Veja como fica:
- H2SO3: Ácido sulfuroso;
- H2SO4: Ácido sulfúrico.
Outros exemplos de oxiácidos são:
- HNO2: Ácido nitroso;
- HNO3: Ácido nítrico;
- H3PO2: Ácido fosforoso;
- H3PO4: Ácido fosfórico;
- HClO2: Ácido cloroso;
- HClO3: Ácido clórico.
Alguns oxiácidos, além do sufixo, apresentam prefixos. Para compreender qual prefixo usar é importante saber determinar o Nox (Número de Oxidação) dos elementos presentes na molécula.
Dependendo do Nox do elemento central da molécula, será utilizado, ou não, um determinado prefixo. A tabela abaixo demonstra o procedimento:
| Prefixo | Nox | Sufixo |
| Hipo | +1 ou +2 | oso |
| - | +3 ou +4 | oso |
| - | +5 ou +6 | ico |
| Per | +7 | ico |
Portanto, haverá prefixos quando o Número de Oxidação for +1, +2 ou +7. Por exemplo:
- HClO: O cloro possui Nox +1, dessa forma o seu nome será Ácido hipocloroso;
- HClO2: O cloro possui Nox +3, dessa forma seu nome será ácido cloroso (sem prefixo, portanto);
- HClO3: O cloro possui Nox +5, dessa forma seu nome será ácido clórico (sem prefixo, portanto);
- HClO4: O cloro possui Nox +7, dessa forma seu nome será ácido perclórico.
Para aprender a encontrar o Nox das substâncias, veja este artigo: Nox: Número de oxidação
Saiba mais:
- Ácidos e Bases;
- Funções químicas;
- Funções inorgânicas;
- Ácidos;
- Exercícios sobre Funções inorgânicas.
Referências Bibliográficas
KOTZ, J. C.; TREICHEL JUNIOR, P. M. Química Geral e Reações Químicas. vol. 1, 5ª. ed., São Paulo: Pioneira Thomson, 2005.
CASTILHO, Rubens. Nomenclatura dos ácidos: entenda as regras e suas aplicações. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/nomenclatura-dos-acidos/. Acesso em:



