Constante de Faraday
O valor da Constante de Faraday (F) é 96485,33289 C mol-1. É uma das constantes elementares da Física que representa a carga molecular A.
Representada pela letra F, a Constante de Faraday recebeu este nome em homenagem ao físico e químico inglês Michael Faraday (1791-1867).
A Constante de Faraday é o resultado da multiplicação do Número de Avogadro (NA) pela carga elétrica do elétron (e) e o seu valor em unidades.
Leis de Faraday
O cientista Michael Faraday propôs regras para a compreensão da eletrólise a partir de experimentos divulgados em 1834. A eletrólise é o processo em que a corrente elétrica determina reações químicas. Pelo conhecimento desse processo, o cientista propôs as chamadas leis da eletrólise ou Leis de Faraday.
As Leis de Faraday ajudam na compreensão da massa corroída e do processo de eletrodecomposição dos minérios.
Primeira Lei de Faraday
A Primeira Lei de Faraday aponta que "a massa de um elemento, depositada durante o processo de eletrólise, é diretamente proporcional à quantidade de eletricidade que atravessa a célula eletrolítica".
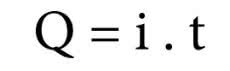
Na equação, Q representa a carga elétrica medida em coulombs (C). A letra i representa a corrente elétrica, cuja unidade de medida o ampère (A). E, por fim, a letra t está representando o intervalo de tempo da passagem da corrente elétrica em segundos (s).
Segunda Lei de Faraday
A Segunda Lei de Faraday indica que "as massas de vários elementos, quando depositadas durante a eletrólise pela mesma quantidade de eletricidade, são diretamente proporcionais aos respectivos equivalentes químicos".
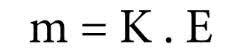
Onde:
- K é uma constante igual a 1/F = 1/96500 C mol-1
- E é o equivalente-grama.
Michael Faraday
O físico e químico Michael Faraday nasceu em Newington, na Inglaterra, em 22 de setembro 1791 e morreu em Hampton Court em 25 de agosto de 1867. Seus estudos possibilitaram o conhecimento de fenômenos da eletricidade, eletroquímica e magnetismo.
Atuou no campo da matemática avançada e seus estudos serviram como base para o desenvolvimento da engenharia. Entre suas principais contribuições está a invenção do gerador elétrico e do transformador elétrico.
Em seus trabalhos na Química, descobriu o benzeno. Além disso, produziu os primeiros cloretos, o C2C16 e o C2C14, compostos importantes que contribuíram para os avanços da metalurgia e da metalografia.
Ainda na Química, foi o responsável pela fundação da eletroquímica e criou os termos eletrólito, ânodo, catodo, eletrodo e íon.
Entenda o que é Gaiola de Faraday.
Veja também sobre:
Constante de Faraday. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/constante-de-faraday/. Acesso em:



