Eletrólise: o que é, os tipos (ígnea e aquosa) e suas aplicações
A eletrólise é uma reação química não-espontânea que envolve uma reação de oxirredução, a qual é provocada por uma corrente elétrica.
Para que a eletrólise aconteça, a corrente elétrica envolvida deve ser contínua e ter voltagem suficiente. Assim, ela poderá ocorrer por fusão (eletrólise ígnea) ou por dissolução (eletrólise aquosa). Isso porque, é necessário haver liberdade de movimentação dos íons envolvidos no processo.
Importância da eletrólise
Muitos materiais e compostos químicos são produzidos a partir do processo de eletrólise, por exemplo:
- alumínio e cobre
- hidrogênio e cloro em cilindro
- bijuterias (processo de galvanização)
- panela de pressão
- roda de magnésio (calotas dos carros).
Leis da Eletrólise
As Leis da Eletrólise foram desenvolvidas pelo físico e químico inglês Michael de Faraday (1791-1867). Ambas as leis regem os aspectos quantitativos da eletrólise.
A primeira Lei da Eletrólise tem o seguinte enunciado:
“A massa de um elemento, depositada durante o processo de eletrólise, é diretamente proporcional à quantidade de eletricidade que atravessa a célula eletrolítica”.
Q = i . t
Onde,
Q: carga elétrica (C)
i: intensidade da corrente elétrica (A)
t: intervalo de tempo da passagem da corrente elétrica (s)
A segunda Lei da Eletrólise tem o seguinte enunciado:
“As massas de vários elementos, quando depositadas durante a eletrólise pela mesma quantidade de eletricidade são diretamente proporcionais aos respectivos equivalentes químicos”.
M = K . E
Onde,
M: massa da substância
K: constante de proporcionalidade
E: equivalente-grama da substância
Saiba mais no artigo: Constante de Faraday.
O que é a eletrólise ígnea
A eletrólise ígnea é aquela que se processa a partir de um eletrólito fundido, ou seja, pelo processo de fusão.
Como exemplo, vamos usar o NaCl (Cloreto de Sódio). Quando aquecemos a substância a 808 °C, ele passa para o estado líquido e os íons presentes (Na+ e Cl-) ganham maior liberdade de movimento.
Quando a corrente elétrica passa na célula eletrolítica, os cátions de Na+ são atraídos pelo polo negativo, chamado de catodo. Já os ânions de Cl-, são atraídos pelo polo positivo, ou o anodo.
No caso do Na+ ocorre uma reação de redução, enquanto no Cl-, ocorre uma reação de oxidação.
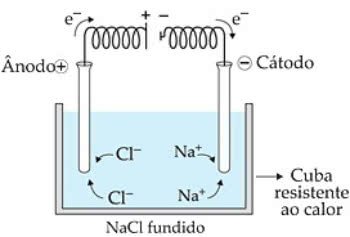
Esquema da Eletrólise Ígnea do NaCl
O que é a eletrólise aquosa
Na eletrólise aquosa, o solvente ionizante utilizado é a água. Em solução aquosa, a eletrólise pode ser realizada com eletrodos inertes ou eletrodos ativos (ou reativos).
Eletrodos Inertes: a água da solução se ioniza conforme a equação:
H2O ↔ H+ + OH-
Com a dissociação do NaCl temos:
NaCl → Na+ + Cl-
Assim, os cátions H+ e Na+ podem ser descarregados no polo negativo, enquanto os ânions OH-e Cl-podem ser descarregados no polo positivo.
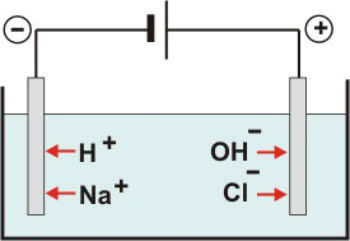
Esquema da Eletrólise Aquosa do NaCl
Nos cátions ocorrem uma reação de redução (redução catódica), enquanto nos ânions, uma reação de oxidação (oxidação anódica).
Assim, temos a reação de eletrólise:
2 NaCl + 2 H2O → 2 Na+ + 2 OH- + H2+ + Cl2-
A partir disso, podemos concluir que as moléculas de NaOH permanecem em solução, enquanto o H2+ é liberado no polo negativo e o Cl2+, no polo positivo.
Esse processo resultará na equação equivalente:
2 NaCl + 2 H2O → 2 NaOH + H2 + Cl2
Eletrodos Ativos: nesse caso, os eletrodos ativos participam da eletrólise, no entanto, sofrem uma corrosão.
Como exemplo, temos a eletrólise em solução aquosa de sulfato de cobre (CuSO4):
CuSO4 → Cu2 + SO4 2-
H2O → H+ + OH-
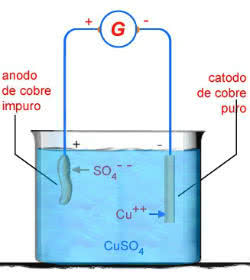 Esquema da Eletrólise Aquosa do CuSO4
Esquema da Eletrólise Aquosa do CuSO4
Nesse caso, o anodo de cobre sofrerá uma corrosão:
Cu0 → Cu2+ + 2e-
Isso ocorre, pois segundo os potenciais-padrão dos eletrodos, a corrente elétrica tem mais facilidade em retirar os elétrons do Cu0 do que do SO42-ou do OH-.
Sendo assim, no polo negativo ocorre a seguinte reação de eletrólise:
2e- + Cu2+ → Cu
Já no polo positivo, temos a reação de eletrólise:
Cu → Cu2+ +2e-
Por fim, ao somarmos as duas equações de eletrólise temos como resultado o zero.
Quer saber mais sobre o tema? Leia os artigos:
Pilha e Eletrólise
A eletrólise é baseada num fenômeno inverso ao da pilha. Na eletrólise, o processo não é espontâneo, como acontece nas pilhas. Ou seja, a eletrólise converte a energia elétrica em energia química, já a pilha gera energia elétrica a partir de energia química.
Saiba mais sobre Eletroquímica.
Exercícios sobre eletrólise
1. (Ulbra-RS) O potássio metálico pode ser produzido pela eletrólise ígnea do cloreto de potássio. A partir dessa afirmação, assinale a alternativa correta.
a) Eletrólise é um processo que envolve reações de oxirredução e redução motivadas pela corrente elétrica.
b) A eletrólise ígnea do cloreto de potássio ocorre a temperatura ambiente.
c) O potássio é encontrado na natureza na forma reduzida (K0).
d) A reação de eletrólise é aquela que ocorre com a ajuda da radiação ultravioleta.
e) No processo de eletrólise do cloreto de potássio, para obtenção do potássio metálico, ocorre a transferência de elétrons de potássio para o cloro.
2. (UFRGS-RS) No cátodo de uma célula de eletrólise sempre ocorre:
a) Deposição de metais.
b) Uma semirreação de redução.
c) Produção de corrente elétrica.
d) Desprendimento de gás hidrogênio.
e) Corrosão química.
3. (Unifor-CE) As proposições a seguir estão relacionadas com eletrólise:
I. As reações de eletrólise ocorrem com consumo de energia elétrica.
II. Soluções aquosas de glicose não podem ser eletrolisadas porque não conduzem corrente elétrica.
III. Nas eletrólises de soluções salinas, os cátions metálicos sofrem oxidação.
Podemos afirmar que apenas:
a) I é correta.
b) II é correta.
c) III é correta.
d) I e II são corretas.
e) II e III são corretas.
4. (FEI-SP) Dois alunos de Química realizaram eletrólise do BaCl2; a primeira aquosa e, a segunda, ígnea. Com relação ao resultado, podemos afirmar que ambas obtiveram:
a) H2 e O2 nos ânodos.
b) H2 e Ba nos ânodos.
c) Cl2 e Ba nos eletrodos.
d) H2 nos cátodos.
e) Cl2 nos ânodos.
5. (Vunesp) “Piscina sem Química” é um anúncio envolvendo tratamento de água. Sabe-se, no entanto, que o tratamento consiste na adição de cloreto de sódio na água e na passagem dessa água por um recipiente dotado de eletrodos de cobre e de platina ligados a uma bateria de chumbo de automóvel.
a) Com base nessas informações, discutir se a mensagem do anúncio é correta
b) Considerando os eletrodos inertes, escrever as equações das reações envolvidas que justificam a resposta anterior.
CASTILHO, Rubens. Eletrólise: o que é, os tipos (ígnea e aquosa) e suas aplicações. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/eletrolise/. Acesso em:



