Oxidação e redução: o que são, exemplos e exercícios
A oxidação e a redução são reações que ocorrem quando há a transferência de elétrons entre espécies químicas. Elas reações opostas: em uma oxidação ocorre a perda de elétrons e na redução há o ganho de elétrons.
Esses processos acontecem simultaneamente, pois quando uma substância doa elétrons para outra ela é oxidada, ao passo que a substância que recebe elétrons sofre redução.
Quando uma substância oxida, ela faz com que a outra espécie reduza, por isso recebe o nome de agente redutor. Da mesma forma, uma substância reduz por causa da oxidação de outra e, por isso, é o agente oxidante.
As reações de oxidação e redução são demonstradas pela variação do número de oxidação (nox) das espécies envolvidas.
Genericamente, uma reação que apresenta oxidação e redução pode ser representada por:
A + B+ → A+ + B
Onde,
A: substância que sofre oxidação, perde elétrons, aumenta nox e é o agente redutor.
B: substância que sofre redução, ganha elétrons, diminui nox e é o agente oxidante.
Exemplos de oxidação e redução
Observe na imagem a seguir um exemplo da equação química de oxirredução.
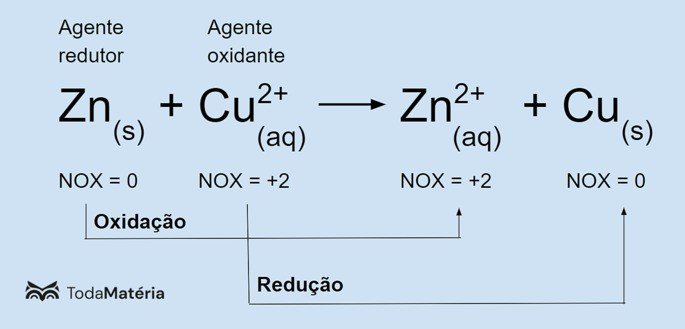
O zinco metálico sofre oxidação e provoca a redução do cobre, por isso é o agente redutor. Seu número de oxidação (nox) aumenta de 0 para +2 porque ele perde 2 elétrons.
O íon cúprico (Cu2+) sofre redução e provoca a oxidação do cobre, por isso é o agente oxidante. Seu número de oxidação (nox) diminui de +2 para 0 porque ele ganha 2 elétrons e se torna o cobre metálico, que é eletricamente neutro.
Outros exemplos de reações de oxirredução no cotidiano são:
Combustão do metano
CH4(g) + 2O2(g) → CO2(g) + 2H2O(v)
Fotossíntese
6CO2(g) + 6H2O(v) → C6H12O6(aq) + 6O2(g)
Corrosão do ferro
2Fe(s) + 3/4O2(g) + 3 H2O(v) → 2Fe(OH)3(s) (ferrugem Fe2O3.3H2O)
Saiba mais sobre o número de oxidação (nox).
Como ocorrem as reações de oxidação e redução?
A equação da reação de oxirredução envolvendo cobre e zinco pode ser representada por meio de semirreações, como demonstrado a seguir.
- Semirreação de oxidação: Zn0(s) → 2e- + Zn2+(aq)
- Semirreação de redução: Cu2+(aq) + 2e- → Cu0(s)
- Equação global: Zn0(s) + Cu2+(aq) → Zn2+(aq) + Cu0(s)
Essa transferência de elétrons na reação de oxirredução ocorre de acordo com o potencial de redução das espécies envolvidas. O componente com menor potencial de redução tem a tendência de doar elétrons, enquanto que o de maior potencial irá recebê-los.
Por exemplo, o zinco tem potencial de redução -0,76V, enquanto o cobre apresenta potencial de redução de +0,34V. Sendo assim, o zinco por ter menor potencial de redução é um melhor agente redutor e promove a redução do cobre, que tem maior potencial de redução e, por isso, ganha elétrons e provoca a oxidação do zinco.
Leia também sobre reações de oxirredução.
Exercícios sobre oxidação e redução
Utilize as questões a seguir para testar seus conhecimentos sobre o que você aprendeu nesse texto.
Questão 1
Sobre as reações de oxidação e redução é correto afirmar que
a) O aumento do nox da espécie química indica que ela sofreu redução.
b) A substância que perde elétrons sofre oxidação e é agente oxidante.
c) Nas reações de oxirredução ocorre a transferência de elétrons.
d) A substância que ganha elétrons sofre redução e é agente redutor.
e) A diminuição do nox da espécie química indica que ela sofreu oxidação.
Questão 2
São exemplos de reações de oxirredução no cotidiano, EXCETO
a) Corrosão
b) Combustão
c) Fotossíntese
d) Neutralização
Questão 3
Observe as reações de oxirredução a seguir e indique quais são os agentes oxidantes e redutores.
I. Zn0(s) + Cu2+(aq) → Zn2+(aq) + Cu0(s)
II. Cu2+(aq) + H2(g) → 2H+(aq) + Cu(s)
III. Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g)
Adquira mais conhecimento com os conteúdos:
Referências Bibliográficas
FONSECA, M. R. M. Química, 2. 1. ed. São Paulo : Ática, 2013.
SANTOS, W.L.P; MOL, G.S. Química cidadã, 3. 2. ed. São Paulo: Editora AJS, 2013.
USBERCO, J. Conecte química, 2: química. - 2. ed. São Paulo: Saraiva, 2014.
BATISTA, Carolina. Oxidação e redução: o que são, exemplos e exercícios. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/oxidacao-e-reducao/. Acesso em:


