Reações de oxirredução: o que são, exemplos e exercícios
As reações de oxirredução envolvem a transferência de elétrons entre as espécies químicas, o que é evidenciado pela mudança no número de oxidação (nox) dos participantes da reação.
Podemos observar exemplos desse tipo de reação no dia a dia, com a combustão, a fotossíntese e a formação da ferrugem.
A oxirredução consiste na ocorrência simultânea dos processos de oxidação e redução:
Oxidação: resulta na perda de elétrons e aumento do nox.
Redução: resulta no ganho de elétrons e diminuição do nox.
Ao mesmo tempo que um elemento cede elétrons, outro irá recebê-los. Assim, o número total de elétrons recebidos é igual ao total de elétrons perdidos.
Conforme o elemento que recebe ou doa os elétrons temos as seguintes denominações:
Agente redutor: aquele que sofre oxidação, provoca a redução e aumenta o seu número de nox. É o que perde elétrons.
Agente oxidante: aquele que sofre redução, provoca a oxidação e diminui o seu número de nox. É o que ganha elétrons.
O número de oxidação (nox) representa a carga elétrica de um elemento no momento em que participa de uma ligação química.
Essa condição está relacionada com a eletronegatividade, que é a tendência que alguns elementos apresentam para receber elétrons. Portanto, quanto mais eletronegativo maior a tendência de ganhar elétrons.
Observe o exemplo de reação de oxirredução a seguir.
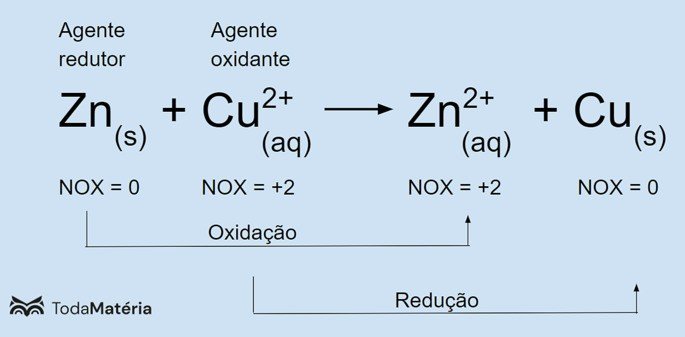 No exemplo dado, o zinco (Zn) sofreu oxidação e perdeu 2 elétrons. Por isso, seu nox aumentou e passou de 0 para +2. O cobre (Cu) sofreu uma redução e ganhou 2 elétrons. Portanto, seu nox diminuiu e passou de +2 para 0.
No exemplo dado, o zinco (Zn) sofreu oxidação e perdeu 2 elétrons. Por isso, seu nox aumentou e passou de 0 para +2. O cobre (Cu) sofreu uma redução e ganhou 2 elétrons. Portanto, seu nox diminuiu e passou de +2 para 0.
O zinco é um agente redutor porque doou elétrons para o cobre e, assim, promoveu a sua redução. Já o cobre participou da reação como agente oxidante porque ao receber os elétrons do zinco fez com que o metal se oxidasse.
Note que em uma reação de oxirredução, o nox de substâncias simples é igual a zero. Já os íons presentes na reação têm o nox igual a sua carga.
Exemplos de oxirredução
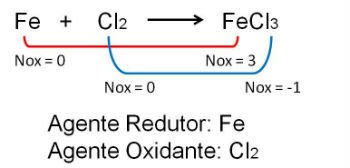
1. No primeiro exemplo, a reação entre o ferro e o cloro ocorre mudança do número de oxidação. O cloro por ser mais eletronegativo ganha elétrons e sofre redução, enquanto o ferro doa elétrons e oxida.
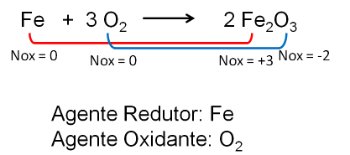
2. Na reação entre o ferro e o oxigênio, o oxigênio é mais eletronegativo, acaba por receber elétrons e diminui o seu número de oxidação.
Saiba mais, leia também sobre oxidação e redução.
Exercícios resolvidos sobre reações de oxirredução
Questão 1
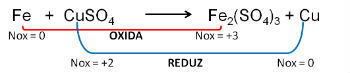
(PUC-RS) Em relação à equação de oxidação - redução não balanceada Fe0 + CuSO4 → Fe2(SO4)3 + Cu0, pode-se afirmar que o:
a) número de oxidação do cobre no sulfato cúprico é +1.
b) átomo de ferro perde 2 elétrons.
c) cobre sofre oxidação.
d) ferro é agente oxidante.
e) ferro sofre oxidação.
Questão 2
(UFAC-AC) Na seguinte equação química: Zn + 2 HCℓ → ZnCℓ2 + H2
a) o elemento Zn oxida-se e reage como agente oxidante.
b) o elemento Zn oxida-se e reage como agente redutor.
c) o elemento Zn reduz-se e reage como agente redutor.
d) o HCℓ é um agente redutor.
e) a equação é classificada como reversível.
Questão 3
(ITA-SP) Na reação iônica Ni(s) + Cu2+(aq) → Ni2+(aq) + Cu(s)
a) o níquel é o oxidante porque ele é oxidado.
b) o níquel é o redutor porque ele é oxidado.
c) o íon cúprico é o oxidante porque ele é oxidado.
d) o íon cúprico é o redutor porque ele é reduzido.
e) não se trata de uma reação de redox, logo não há oxidante e nem redutor.
Questão 4
(UFRGS) O agente ativo dos alvejantes de uso doméstico é o íon hipoclorito, ClO-. Nos processos de branqueamento, esse íon sofre redução; isso significa que:
a) a substância que sofre a ação do hipoclorito recebe elétrons.
b) ocorre diminuição do número de elétrons na sua estrutura.
c) ClO- é agente redutor.
d) ClO- é convertido em cloro elementar ou íon cloreto.
e) não ocorre transferência de elétrons.
Adquira mais conhecimento com os conteúdos:
Referências Bibliográficas
FONSECA, M. R. M. Química, 2. 1. ed. São Paulo : Ática, 2013.
SANTOS, W.L.P; MOL, G.S. Química cidadã, 3. 2. ed. São Paulo: Editora AJS, 2013.
USBERCO, João. Conecte química, 2: química. 2. ed. São Paulo: Saraiva, 2014.
BATISTA, Carolina. Reações de oxirredução: o que são, exemplos e exercícios. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/reacoes-de-oxirreducao/. Acesso em: