Pilha: o que é, como funciona e tipos
A pilha é um sistema onde ocorre a reação de oxirredução. Nesse dispositivo, a energia química produzida na reação espontânea é convertida em energia elétrica.
As reações de oxidação e redução ocorrem simultaneamente em uma pilha. Quando uma espécie sofre oxidação ela doa elétrons para a outra espécie que, ao recebê-los, sofre redução.
Portanto, quem sofre oxidação é o agente redutor e quem sofre redução é o agente oxidante.
A oxidação ocorre quando uma espécie perde elétrons e se transforma em um cátion: A → A+ + e-.
A redução ocorre quando uma espécie ganha elétrons e se torna eletricamente neutra: B+ + e- → B.
Nas equações químicas, essa transferência de elétrons é demonstrada pela mudança do número de oxidação (nox).
As reações de oxirredução ocorrem no interior das pilhas e a corrente elétrica surge com a migração dos elétrons do polo negativo para o positivo.

Como funciona uma pilha?
Uma reação de oxirredução genericamente pode ser representada pela equação:
A + B+ → A+ + B
Onde,
A: substância que sofre oxidação, perde elétrons, aumenta nox e é o agente redutor.
B: substância que sofre redução, ganha elétrons, diminui nox e é o agente oxidante.
Observe na imagem a seguir como esse processo pode ser representado.
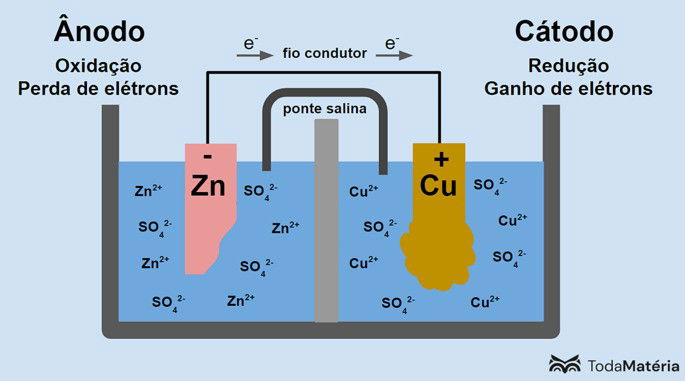
O sistema dividido em duas semicelas e formado por dois eletrodos metálicos conectados externamente por um fio condutor foi desenvolvido por John Frederic Daniell (1790-1845) em 1836.
A pilha é composta por dois eletrodos, conectados por um fio condutor, e um eletrólito, onde ficam os íons. O eletrodo é a superfície sólida condutora que possibilita a troca de elétrons.
Ânodo: eletrodo no qual ocorre a oxidação. É também o polo negativo da pilha.
Cátodo: eletrodo no qual ocorre a redução. É também o polo positivo da pilha.
Na imagem acima, o zinco metálico é o ânodo e sofre a oxidação. O cobre metálico é o cátodo e sofre redução. A migração dos elétrons (e-) ocorre do ânodo para o cátodo através do fio condutor.
As reações que ocorrem no sistema da imagem são:
- Ânodo (oxidação): Zn(s) → Zn2(aq) + 2e-
- Cátodo (redução): Cu2+(aq) + 2e- → Cu(s)
- Equação geral: Zn(s) + Cu2+(aq) → Cu(s) + Zn2+(aq)
O zinco é um metal com maior tendência de perder elétrons e, por isso, formam-se cátions na solução. O eletrodo de zinco começa a apresentar um desgaste e perda de massa porque o zinco é liberado na solução ao formar os cátions Zn2+.
Os elétrons provenientes do ânodo chegam ao cátodo e os cátions do metal ao recebê-los transformam-se em cobre metálico, que se deposita no eletrodo e aumenta sua massa.
A ponte salina é uma corrente iônica responsável pela circulação de íons no sistema para mantê-lo eletricamente neutro.
Leia também sobre número de oxidação (nox).
Tipos de pilha
Em uma pilha, a tendência das espécies químicas receberem ou doarem elétrons é determinada pelo potencial de redução.
O componente com maior potencial de redução tende a sofrer redução, ou seja, ganhar elétrons. A espécie de menor potencial de redução e, consequentemente, maior potencial de oxidação, tende a transferir elétrons.
Por exemplo, na reação de oxirredução Zn0(s) + Cu2+(aq) → Cu0(s) + Zn2+(aq)
O zinco oxida e doa elétrons porque tem potencial de redução E0 = -0,76V, menor que o potencial de redução do cobre E0 = +0,34V e, por isso, este recebe elétrons e sofre redução.
Confira a seguir outros exemplos de pilhas.
Pilha de zinco e hidrogênio
Semirreação de oxidação: Zn(s) → Zn2+ + 2e- (E0 = -0,76V)
Semirreação de redução: 2H+(aq) + 2e- → H2(g) (E0 =0,00V)
Equação global: Zn(s) + 2H+(aq) → Zn2+(aq) + H2(g)
Representação da pilha:
Pilha de cobre e hidrogênio
Semirreação de oxidação: H2(g) → 2H+(aq) + 2e- (E0 = 0,00V)
Semirreação de redução: Cu2+(aq) + 2e- → Cu(s) (E0 = +0,34V)
Equação global: Cu2+(aq) + H2(g) → 2H+(aq) + Cu(s)
Representação da pilha:
Adquira mais conhecimento sobre o tema com os conteúdos:
Referências Bibliográficas
FONSECA, M. R. M. Química, 2. 1. ed. São Paulo : Ática, 2013.
SANTOS, W.L.P; MOL, G.S. Química cidadã, 3. 2. ed. São Paulo: Editora AJS, 2013.
USBERCO, J. Conecte química, 2: química. - 2. ed. São Paulo: Saraiva, 2014.
BATISTA, Carolina. Pilha: o que é, como funciona e tipos. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/pilha/. Acesso em:


