Dissociação iônica
A dissociação iônica é a separação de íons que ocorre a partir de compostos iônicos dissolvidos em água.
A água interage com os íons e provoca a sua separação, um fenômeno denominado de solvatação.
O processo de dissociação foi descoberto pelo físico-químico Svant August Arrhenius (1859-1927).
Ele observou que algumas substâncias quando colocadas em água podiam conduzir eletricidade. Assim, Arrhenius sugeriu que nas soluções aquosas deviam existir partículas carregadas eletricamente, os íons.
É importante ressaltar que apenas as substâncias iônicas, como sais e bases, sofrem dissociação quando em soluções ou fundidos.
Processo
Para exemplificar o processo de dissociação, podemos utilizar o NaCl, o sal de cozinha.
Quando o NaCl é colocado em água, temos a seguinte equação:
O NaCl é um composto iônico, por isso os íons já existiam, o que ocorreu foi apenas a separação entre eles através da ação da água.
Agora temos um outro exemplo utilizando uma base:
O NaOH, uma base, quando colocado em água, a ligação entre o Na+ e OH- é rompida e os mesmos são liberados no meio.
Lembre-se que as bases são substâncias que liberam íons hidroxila (ânions OH–) em solução aquosa.
Outros exemplos de dissociação iônica em bases:
1)
2)
É importante ressaltar que os íons livres em soluções aquosas podem conduzir eletricidade.
Dissociação e Ionização
Entenda a diferença entre dissociação iônica e ionização:
- Dissociação iônica: É o processo físico de separação de íons que ocorre em sais e bases.
- Ionização: É uma reação química que origina íons a partir de ácidos colocados em água.
Assim, a ionização é o processo de formação de íons. Exemplo:
No caso do HCl (ácido clorídrico), a ligação química entre o H e Cl é quebrada e formam-se os íons H+ e Cl-.
Em comum, na dissociação e ionização os elétrons livres podem conduzir eletricidade.
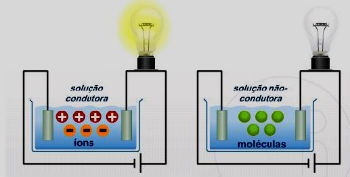
Tal situação não ocorre, por exemplo, com o açúcar (C12H22O11) que não forma íons em solução aquosa.
Portanto, não há condução de eletricidade e o açúcar apenas se dissolve na água.
Para praticar: Exercício sobre dissociação e ionização (com questões explicadas)
MAGALHÃES, Lana. Dissociação iônica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/dissociacao-ionica/. Acesso em:


