Teoria de Arrhenius
A teoria de Arrhenius foi criada pelo químico sueco Svante August Arrhenius. Seus experimentos constataram quais tipos de substâncias seriam capazes de formar íons e como isso estava relacionado à condutividade elétrica.
Assim, ele verificou que algumas soluções aquosas eram capazes de conduzir eletricidade e outras não.
Arrhenius também percebeu que seria possível definir o caráter ácido-base de um composto quando o colocasse em contato com a água.
Para o químico, um ácido liberaria íons H+ em solução. Já uma base, geraria íons OH- na água.
Além disso, a partir das suas observações, formulou definições para ácidos, bases e sais.
Teoria da dissociação iônica
No final do século XIX, Arrhenius estudou a condução de eletricidade em soluções aquosas através de experimentos com sal e açúcar em água e, de acordo com os resultados, propôs a teoria da dissociação iônica.
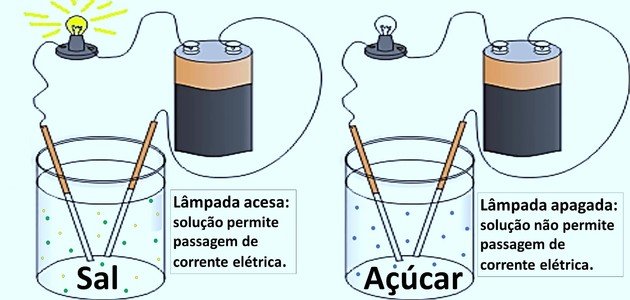
Ele observou que o açúcar ao ser colocado em água, sofria a subdivisão em moléculas neutras e não conduzia eletricidade. Por isso, foi classificado como não eletrólito.
O sal teve o comportamento oposto: subdividiu-se em partículas eletricamente carregadas, denominadas íons, e fez com que ocorresse a passagem de corrente elétrica. Por isso, foi classificado como eletrólito.
Os compostos não eletrólitos são espécies moleculares, enquanto que os eletrólitos podem ser substâncias moleculares ou iônicas.
Moléculas podem se ionizar em solução e gerar espécies carregadas eletricamente, enquanto que compostos iônicos dissociam-se em solução e liberam íons.
Ionização x dissociação iônica
Os íons livres em uma solução surgem da ionização de substâncias moleculares ou da dissociação de substâncias iônicas. Esses íons fazem com que a solução conduza eletricidade.
Ionização
No processo de ionização, as ligações covalentes dos compostos moleculares são desfeitas e os íons são formados em solução.
Exemplo:
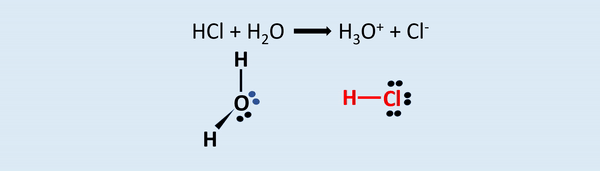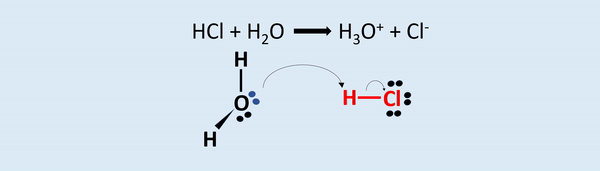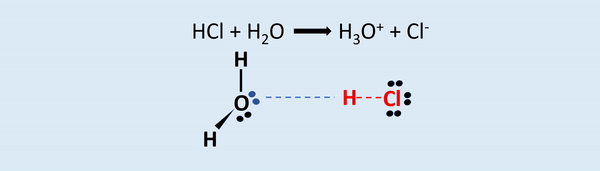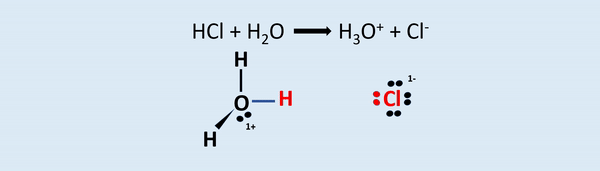
O ácido HCl possui um hidrogênio ionizável, que se liga a molécula de água e forma o íon hidrônio. O Cloro, por sua vez, atrai o par de elétrons para si por possuir maior eletronegatividade.
Dissociação
No processo de dissociação, o composto tem suas ligações iônicas rompidas e libera íons em solução.
Exemplo:
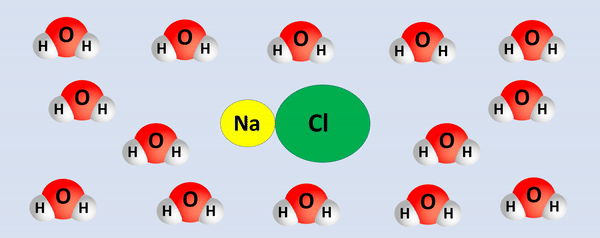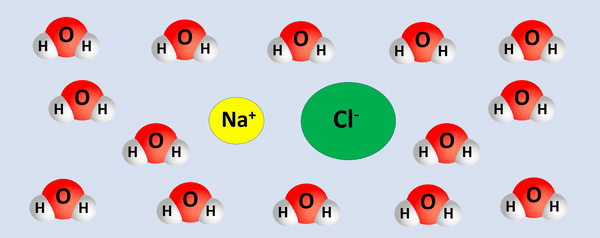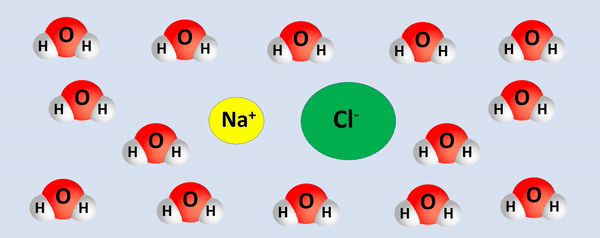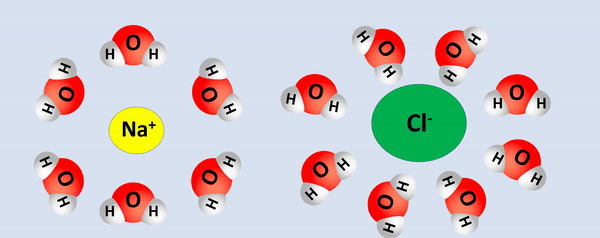
A dissociação do sal NaCl ocorre conforme a equação química:
O polo positivo da água (H+) envolve os ânions (carga negativa) formados na dissociação. Já o polo negativo (O2-) é atraído pelos cátions (carga positiva) gerados.
Teoria ácido-base de Arrhenius
A constatação da existência dos íons fez com que Arrhenius também formulasse definições para ácidos e bases de acordo com as cargas liberadas em solução.
Teoricamente, Arrhenius definiu os ácidos da seguinte forma:
Ácidos são substâncias que ionizam em solução e produzem um íon com carga positiva, o cátion hidrogênio (H+).
Para o químico, liberar íons H+ em solução seria uma propriedade comum a todos os ácidos.
Exemplos:
Em contrapartida, Arrhenius constatou que as bases eram caracterizadas por outras espécies químicas, conforme a definição a seguir:
Bases são substâncias que dissociam em solução e produzem um íon com carga negativa, o ânion hidróxido (OH-).
De acordo com essa definição, a hidroxila (OH-) seria uma propriedade comum a todas as bases.
Exemplos:
Sais
Outra definição proposta por Arrhenius são para substâncias denominadas sais.
Sais são compostos que em solução liberam pelo menos um cátion diferente de H+ e um ânion diferente de OH-.
Exemplos:
A reação entre um ácido e uma base de Arrhenius tem como produto sal e água.
Esse tipo de reação química é chamada de neutralização.
Quem foi Arrhenius?

Não deixe de conferir questões de vestibulares sobre o tema, com resolução comentada, em: exercícios sobre funções inorgânicas.
BATISTA, Carolina. Teoria de Arrhenius. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/teoria-arrhenius/. Acesso em:


