Equilíbrio Iônico
O equilíbrio iônico é um caso particular do equilíbrio químico e estuda o comportamento dos íons em solução.
Uma solução é classificada como eletrólito forte pela grande quantidade de espécies iônicas liberadas em solução. Já um eletrólito fraco tem o número de íons reduzido.
O equilíbrio é medido pela constante de equilíbrio e pelo grau de equilíbrio. Para que ele ocorra, é necessário que a temperatura seja constante e o sistema não tenha trocas com o ambiente.
Equilíbrio iônico de ácidos e bases
Os exemplos mais comuns de equilíbrios iônicos são os que envolvem ácidos e bases em solução aquosa.
Ionização do ácido
Ácido é um composto covalente que ioniza em água e libera H+ em solução, formando íons hidrônio H3O+.
O deslocamento do equilíbrio está relacionado com a força do ácido: quanto mais forte o ácido, o equilíbrio será deslocado para direita, no sentido de formação das espécies iônicas.
Dissociação da base
Base é um composto iônico que se dissocia em água e libera íons OH-.
O deslocamento do equilíbrio está relacionado com a força da base: quanto mais forte a base, o equilíbrio será deslocado para direita, no sentido de liberação das hidroxilas em solução.
Constante de equilíbrio para ácidos e bases
A constante de equilíbrio é uma grandeza que caracteriza o equilíbrio, levando em consideração os aspectos cinéticos das reações químicas.
Ela é obtida a partir das concentrações das espécies, conforme a expressão a seguir:
Constante de ionização
Para os ácidos, utiliza-se a constante de ionização, que é definida a partir de Kc.
| Reação | |
|---|---|
| Constante de ionização |
Considerando que a água é um líquido puro, a concentração dessa substância não participa do cálculo da constante e é substituída pelo número 1.
Constante de dissociação
Para as bases, utiliza-se a constante de dissociação, que é definida a partir de Kc.
| Reação | |
|---|---|
| Constante de dissociação |
Quanto aos valores das constantes é importante lembrar que:
- Quanto maior o valor de Ka, mais forte é o ácido.
- Quanto maior o valor de Kb, mais forte é a base.
- O valor da constante varia conforme a temperatura.
Lei da diluição de Ostwald
O químico alemão Wilhelm Ostwald (1853-1932), de acordo com suas observações sobre os equilíbrios iônicos, formulou a seguinte lei:
Um eletrólito (ácido, base ou sal) cuja concentração em mols diminui no volume da solução, a uma dada temperatura, tem seu grau de ionização ou dissociação elevado.
A lei de diluição de Ostwald relaciona:
- Constante de ionização (K)
- Grau de dissociação (
)
- Concentração em mol/L (M)
| Para monoácidos |
Ao trabalhar com ácidos fracos, cujo |
|---|---|
| Para monobases |
Ao trabalhar com bases fracas, cujo |
Essas expressões são úteis para prever o comportamento ácidos e bases fracas quando ocorre uma diluição.
Quando aumentamos o volume da solução, diminuímos a concentração, pois:
Consequentemente, o grau de dissociação aumenta para que o valor de K permaneça constante, já que ele só modifica com a temperatura.
Saiba mais sobre:
Deslocamento de equilíbrios iônicos
Três fatores podem alterar o equilíbrio químico: pressão, temperatura e concentração.
Os equilíbrios em fase gasosa são mais sensíveis às variações de pressão. Já as mudanças de temperatura, alteram o valor da constante de equilíbrio e favorecem reações que absorvem calor.
Considerando a temperatura constante, temos que o fator que altera o equilíbrio iônico em fase aquosa é a concentração.
Efeito do íon comum
Segundo o Princípio de Le Chatelier, quando ocorre uma perturbação em um sistema em equilíbrio, esse sistema reage para minimizar a alteração sofrida.
Quando adicionamos substâncias ou íons que já participam de um equilíbrio, haverá um deslocamento que gerará o consumo da espécie e um novo equilíbrio será estabelecido.
Exemplo:
A dada temperatura, a equação a seguir está em equilíbrio:
Calculando a constante de equilíbrio com os valores dados, temos que:
Se adicionarmos à solução 0,35 mol de uma substância que contenha a espécie A-, aumentaremos a quantidade dela no meio.
Como o sistema está em equilíbrio, haverá um deslocamento para a esquerda, de forma que o excesso da espécie A- seja consumido, e o valor constante de equilíbrio seja restabelecido.
Pela estequiometria da reação, vemos que 0,1 mol de H+ reagiu com 0,1 mol de A- e produziu 0,1 mol de HA para retornar ao equilíbrio.
Mudaram-se os valores das concentrações, mas a constante de equilíbrio permanece a mesma.
Com esse exemplo, podemos observar que o íon comum:
- Diminui o grau de ionização do ácido.
- Diminui a concentração de H+.
- Aumenta da concentração da substância não ionizada.
- Não altera a constante de equilíbrio.
Efeito do íon não comum
O deslocamento de equilíbrio também ocorre quando se é adicionado um íon que reaja com um participante do equilíbrio.
Acontece a retirada ou adição de uma substância e o sistema restabelecerá o equilíbrio produzindo ou consumindo mais dela.
Exemplo:
A dada temperatura, a equação a seguir está em equilíbrio:
O equilíbrio pode ser deslocado de duas formas:
- Adição de ácido: o excesso de íons H3O+ desloca o equilíbrio para direita consumindo os íons hidrônio e a solução ficará laranja pela produção do dicromato.
- Adição de base: a hidroxila liberada pela base consome os íons H3O+ e o sistema desloca o equilíbrio para esquerda, produzindo mais desse íon e a solução fica amarela pela produção do cromato.

Exercícios
1. (PUC-MG) A tabela a seguir se refere a dados de forças relativas de ácidos em soluções aquosas, à temperatura ambiente. Das soluções aquosas da tabela, a melhor condutora de eletricidade é:
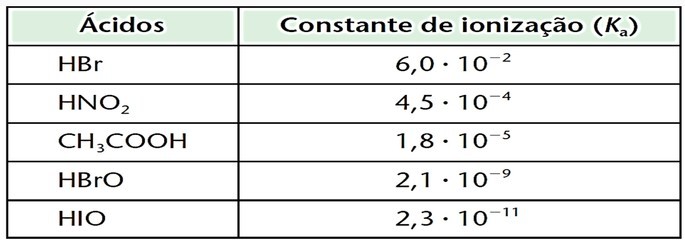
a) 0,1 mol/L de HNO2
b) 0,1 mol/L de HBr
c) 0,1 mol/L de CH3COOH
d) 0,1 mol/L de HBrO
e) 0,1 mol/L de HIO
2. (UFPA) O grau de dissociação iônica do hidróxido de amônio, NH4OH, em solução 2 mol/L é 0,283% na temperatura de 20 °C. A constante de ionização da base, nessa temperatura, é igual a:
a) 1,6 ∙ 10–5
b) 1,0 ∙ 10–3
c) 4,0 ∙ 10–3
d) 4,0 ∙ 10–2
e) 1,6 ∙ 10–1
3. (Fuvest) No vinagre ocorre o seguinte equilíbrio:
Que efeito provoca nesse equilíbrio a adição de uma substância básica? Justifique sua resposta.
Para mais questões, com resolução comentada, veja também:
BATISTA, Carolina. Equilíbrio Iônico. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/equilibrio-ionico/. Acesso em:


