Indicadores ácido-base
Indicadores ácido-base são substâncias que, na prática, nos indicam o pH de uma solução pela mudança de coloração.
Quanto mais ácida uma solução, maior a quantidade de íons hidrônio (H3O+) e menor o pH. Por outro lado, quanto menor a concentração dessa espécie, a solução é básica e o pH é elevado.
O ponto de viragem de um indicador representa a faixa de pH em que é perceptível a mudança de cor.
Embora existam aparelhos que medem o pH através da condutividade da solução, os indicadores são muito utilizados pela comodidade e facilidade de manuseio.
O papel tornassol é o mais antigo dos indicadores, mas hoje muitos outros utilizados. Os mais conhecidos são: fenolftaleína, alaranjado de metila e azul de bromotimol.
O indicador universal apresenta o pH em uma ampla faixa de indicação e mudança gradual de cor, pois é composto de uma mistura de indicadores.
| Indicador | Cor na solução | Ponto de viragem | ||
|---|---|---|---|---|
|
Meio ácido (pH < 7) |
Meio neutro (pH = 7) |
Meio básico (pH > 7) |
||
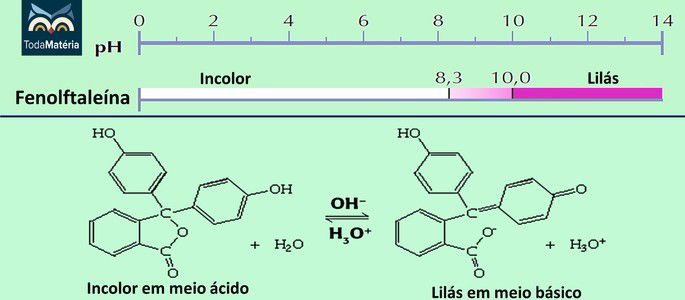
| Fenolftaleína | incolor | incolor | lilás | 8,2 – 10,0 |
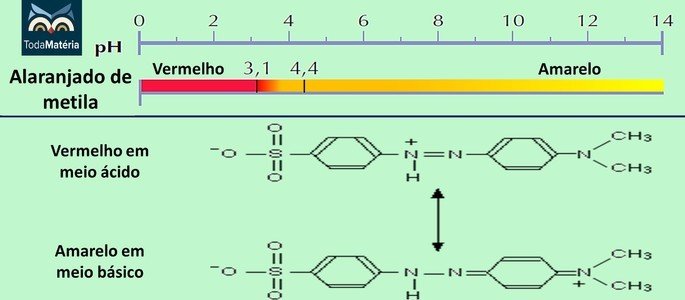
| Alaranjado de metila | vermelho | alaranjado | amarelo | 3,1 – 4,4 |
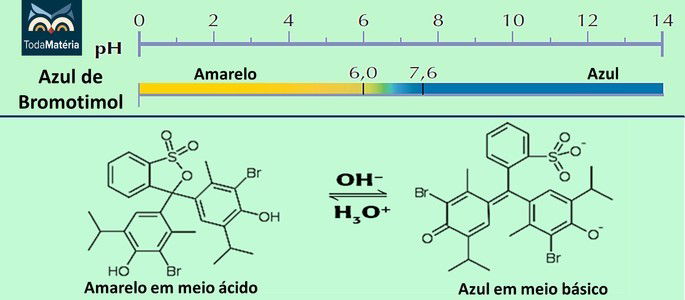
| Azul de bromotimol | amarelo | verde | azul | 6,0 – 7,6 |
| Tornassol | vermelho | amarelo | azul | 5,0 – 8,0 |
| Indicador universal | de vermelho a alaranjado | amarelo esverdeado | de azul a verde | – |
Como funcionam os indicadores ácido-base?
O pH é o potencial hidrogeniônico e a escala de pH, que varia de 0 até 14, é útil para medir quão ácida ou básica é uma solução.
As substâncias utilizadas como indicadores são grandes moléculas orgânicas, naturais ou sintéticas, que possuem o caráter de um ácido fraco ou base fraca.
Se o indicador for um ácido fraco, ele possui uma cor na forma de ácido (HIn), outra cor na forma de base conjugada (In-) e essas espécies estão em equilíbrio químico.
Ao entrar em contato com uma solução de pH ácido (pH < 7), a concentração de íons hidrônio (H3O+) aumenta e desloca o equilíbrio para esquerda, consumindo-os e formando a espécie HIn para estabelecer um novo equilíbrio conforme o Princípio de Le Chatelier. Por isso, a solução torna-se azul.
Por outro lado, ao estar em solução básica (pH > 7), os íons hidroxila (OH-) da base reagem com os íons hidrônio (H3O+), formando água. Ao aumentar a concentração de água, o sistema reage deslocando o equilíbrio para direita. Sendo assim, mais base conjugada é formada e a solução apresenta cor vermelha.
A mudança de cor de uma substância indicadora ocorre em diferentes faixas de pH. Por isso, ao escolher um indicador, devemos levar em consideração:
- A diferença da 1ª e 2ª cor para que possamos perceber com facilidade a sua mudança.
- A mudança de coloração deve ser rápida.
Para que servem os indicadores ácido-base?
Os indicadores servem para mostrar se um material é ácido ou básico, pois só de olharmos não conseguimos fazer essa distinção. Por isso, os indicadores são utilizados para nos dar uma indicação aproximada do pH de uma substância.
Veja a seguir o pH de diferentes materiais que utilizamos no nosso dia a dia:
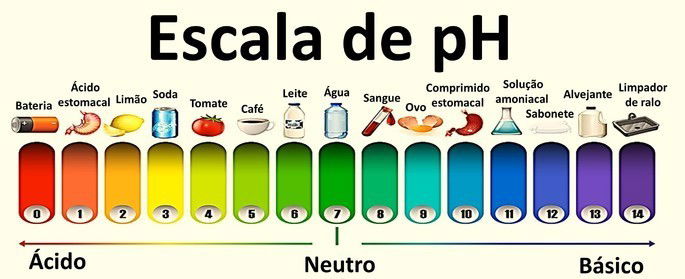
Os indicadores mais utilizados no cotidiano são os papéis indicadores de pH, que são impregnados com uma ou mais substâncias indicadoras. Confira onde eles podem ser utilizados.
Medir o pH da piscina
Para garantir que a piscina esteja adequada para ser utilizada, um dos parâmetros a serem medidos é o pH. Isso é necessário para que não causemos danos aos olhos, cabelos e pele.

Para essa finalidade, são comercializados kits, em fitas ou gotas, que verificam o pH da água. No caso da fita, basta mergulhá-la por apenas 2 segundos na água e conferir a coloração na escala disponível na embalagem.
Medir o pH do corpo humano
Nosso corpo tem pH levemente alcalino. Sendo assim, alterações na faixa de pH influenciam no funcionamento do organismo e na manifestação de doenças.
Por isso, pode ser útil medir o pH da urina e da saliva utilizando fitas medidoras. O papel tornassol é um indicador ácido-base que nos dá uma resposta rápida de como anda a saúde do nosso corpo.
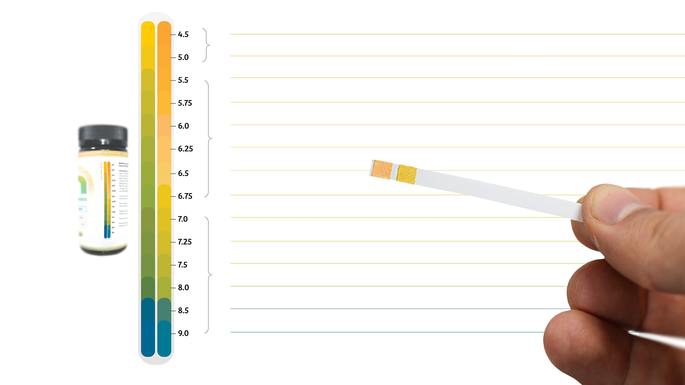
Medir o pH da saliva é importante para saber como está a saúde bucal. A saliva funciona como solução tampão, diminuindo a acidez da boca para impedir a proliferação de microrganismos que produzem ácidos, ao consumir o açúcar que ingerimos, e que levam ao aparecimento das cáries.
Medir o pH da urina nos indica se o pH do sangue está dentro do limite adequado ou se há algum distúrbio no nosso organismo. Se o pH estiver fora do normal, pode ser que não estejamos nos alimentando corretamente, por exemplo.
Vale lembrar que esses testes são úteis para indicação, mas sozinhos não dizem como está a saúde. Por isso, para qualquer dúvida é recomendável procurar um médico e realizar outros exames.
Exemplos de indicadores ácido-base
Confira as estruturas químicas dos indicadores de pH mais conhecidos.
Fenolftaleína
A fenolftaleína é o indicador mais utilizado em titulações ácido-base.
Azul de Bromotimol
Esse indicador é bastante utilizado para determinar o pH de aquários, tanques de peixes e piscinas.
Alaranjado de Metila
Esse indicador é bastante utilizado em titulações ácido-base.
Teste seus conhecimentos sobre pH com questões de vestibulares e gabarito comentado por especialista em: Exercícios sobre pH e pOH.
BATISTA, Carolina. Indicadores ácido-base. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/indicadores-acido-base/. Acesso em:



