Exercícios sobre a hibridização do carbono (com gabarito explicado)
A hibridização do carbono é o processo de reorganização dos orbitais atômicos para formar ligações químicas com geometria definida. Esse conceito ajuda a entender a estrutura molecular e o tipo de ligação que o carbono estabelece em compostos orgânicos.
Estude mais sobre o assunto praticando com os exercícios abaixo.
Questão 1
A geometria de uma molécula orgânica pode ser avaliada de acordo com a hibridização dos seus carbonos. Por exemplo, moléculas orgânicas com carbonos sp3 apresentam majoritariamente geometrias tetraédricas em todas as suas porções.
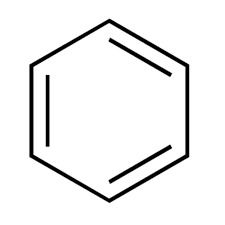
Pensando nisso, assinale a alternativa que explica corretamente o fato de a molécula de benzeno ser uma molécula planar.
a) A molécula de benzeno apresenta todos os carbonos com hibridização sp2, característica de carbonos que formam geometria trigonal plana no seu entorno
b) A molécula de benzeno apresenta todos os carbonos com hibridização sp2, característica de carbonos que formam geometria linear no seu entorno
c) A molécula de benzeno apresenta todos os carbonos com hibridização sp, característica de carbonos que formam geometria trigonal plana no seu entorno
d) A molécula de benzeno apresenta todos os carbonos com hibridização sp, característica de carbonos que formam geometria linear no seu entorno
e) A molécula de benzeno apresenta todos os carbonos com hibridização sp3, característica de carbonos que formam geometria trigonal plana no seu entorno
A molécula de benzeno apresenta 6 carbonos, cada um fazendo 1 ligação dupla. Assim, sabemos que carbonos que fazem apenas 1 ligação dupla apresentam hibridização sp2, característica de geometria de grupo trigonal plana. Enfileirando 6 átomos de carbono com geometria trigonal plana em uma cadeia fechada, a molécula de benzeno acaba apresentando a característica de ser planar.
Questão 2
Em uma prova, Pedro escreveu que a molécula de formaldeído apresenta ligação e, portanto, esta deveria apresentar carbonos com hibridização sp. Analise as alternativas e assinale a correta:
a) Pedro está correto, pois ligações correspondem a insaturações
b) Pedro está errado, pois existem carbonos com apenas ligações simples com hibridização sp
c) Pedro está errado, pois há carbonos com ligações que apresentam também hibridização sp2
d) Pedro está correto, pois todo carbono com ligação apresenta hibridização sp
Há 2 casos em que a hibridização informa que há ligação dupla em uma molécula:
- Quando o carbono faz 1 dupla e apresenta, obrigatoriamente, hibridização sp2
- Quando o carbono faz 2 duplas ou 1 tripla e apresenta, obrigatoriamente, hibridização sp.
Portanto, o fato de haver ligação não garante que o carbono terá hibridização sp.
Questão 3
A hibridização do carbono recebe esse nome, pois há a interação dos orbitais atômicos (s e p) do carbono formando novos orbitais (híbridos). No caso da hibridização sp3, 3 orbitais atômicos p se combinam com 1 orbital atômico s, formando 4 orbitais híbridos sp3. Já para a hibridização sp2, 2 orbitais atômicos p se combinam com 1 orbital atômico s, formando 3 orbitais híbridos sp2. Neste último caso, 1 orbital p não foi hibridizado, tornando-o um orbital p puro. Esta regra também segue o mesmo padrão para a hibridização sp. É a partir do orbital p puro que são feitas as ligações , onde 1 orbital p puro de um átomo interage com 1 orbital p puro de outro (adjacente).
Considerando as informações do texto, determine o número de orbitais p puros que uma molécula de butadieno apresenta.
a) 1
b) 2
c) 4
d) 8
Um butadieno apresenta 2 ligações entre carbonos, como por exemplo:
CH2 = CH - CH = CH2
Observe que há 2 ligações nesta molécula, 1 em cada ligação dupla. De acordo com o texto, para 1 ligação
são necessário 2 orbitais p puros. Como temos 2 ligações
, o número de orbitais p puros é 4.
Questão 4
Uma molécula com fórmula molecular C5H8, deve apresentar quantos carbonos com hibridização sp3?
a) 1 ou 2
b) apenas 1
c) 1 a 3 carbonos
d) apenas 2
Para a fórmula molecular fornecida, vemos que há deficiência de hidrogênios para o número de carbonos. Esta deficiência pode ser em decorrência da presença de ligações duplas ou de fechamento da cadeia:
1. Cadeia aberta: para este caso, temos 2 situações. Em uma, há 2 ligações duplas em 1 mesmo carbono e no outro há 2 ligações duplas conjugadas (intercaladas). Na 1ª situação, há 2 carbonos (CH2 - CH3) que não fazem ligação dupla e portanto apresentam hibridização sp3. Na 2ª situação, há apenas 1 carbono que não faz ligação dupla e que então terá hibridização sp3.
CH2 = C = CH - CH2 - CH3
CH2 = CH - CH = CH - CH3
Você pode mudar as ligações duplas de lugar e encontrar outras moléculas, mas o resultado será o mesmo.
2. Cadeia fechada: para este caso você pode ter casos de cadeias fechadas (com 3, 4 ou 5 carbonos) com 1 dupla. Assim, você terá 3 carbonos sp3.
Desse modo, você tem a possibilidade de encontrar moléculas com esta fórmula molecular que podem ter 1, 2 ou 3 carbonos sp3.
Questão 5
O acetato de trembolona é um esteróide anabolizante muito utilizado por fisiculturistas e por pessoas comuns sem acompanhamento médico. Este esteróide pode apresentar efeitos colaterais gravíssimos como abstinência, aumento do tamanho do coração, impotência sexual, aumento da pressão sanguínea, aumento da irritabilidade, entre outros.
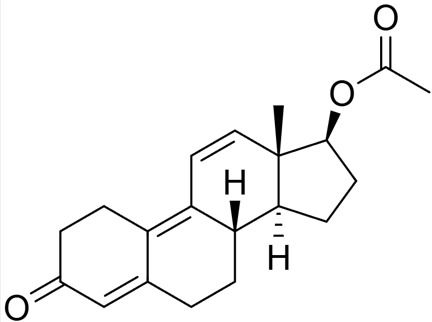
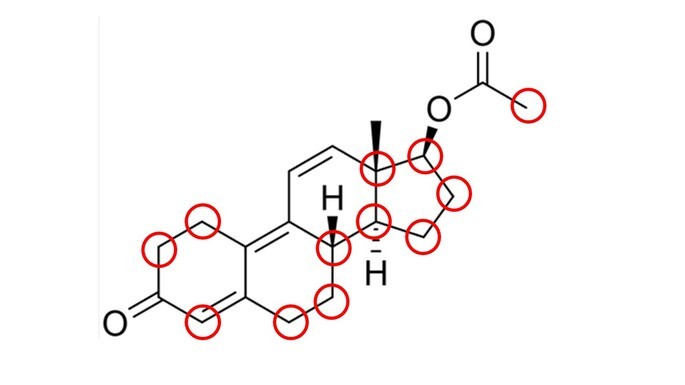
De acordo com sua estrutura, quantos carbonos apresentam hibridização sp3?
a) 11
b) 12
c) 13
d) 14
e) 15
Carbonos com hibridização sp3 são aqueles que fazem apenas ligações simples.
Questão 6
Dada a molécula da cloroquina a seguir, determine o número de carbonos com hibridização sp2
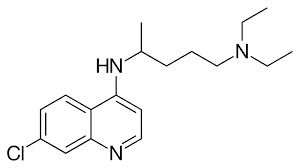
a) 7
b) 8
c) 9
d) 10
e) 6
Carbonos com hibridização sp2 são todos aqueles que apresentam 1 ligação dupla. Olhando para os carbonos dos 2 anéis aromáticos, podemos contar 9 carbonos fazendo 1 ligação dupla.
Continue estudando com mais exercícios:
Exercícios sobre Química Orgânica com gabarito
Exercícios sobre carbono quiral ou assimétrico (com questões resolvidas)
Exercícios sobre geometria molecular (com gabarito comentado)
ALVES, Gustavo. Exercícios sobre a hibridização do carbono (com gabarito explicado). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-hibridizcao-do-carbono/. Acesso em:


