Exercícios sobre ligação covalente (com respostas explicadas)
A ligação covalente está na base da formação das moléculas que compõem a maior parte das substâncias do nosso dia a dia — da água que bebemos aos gases que respiramos.
Para ajudar você a dominar esse tema essencial da Química, selecionamos exercícios com respostas explicadas que abordam desde o conceito de partilha de elétrons até geometria molecular, polaridade e teorias de ligação.
Questão 1
A ligação covalente é formada pela:
a) Transferência de elétrons de um metal para um ametal.
b) Atração entre um cátion e um ânion.
c) Partilha de um ou mais pares de elétrons entre dois átomos.
d) Deslocalização de elétrons em uma rede de cátions.
Resposta: alternativa C.
A ligação covalente surge quando dois átomos, geralmente ambos ametais ou com eletronegatividades semelhantes, compartilham um ou mais pares de elétrons para alcançarem a estabilidade eletrônica.
A transferência (A) é iônica, a atração cátion-ânion (B) é iônica, e a deslocalização (D) é metálica.
Questão 2
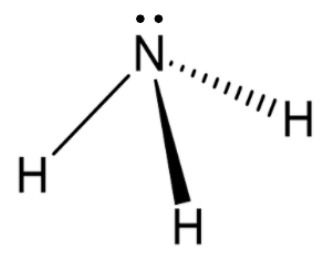
Na molécula de amônia (NH₃), o átomo de nitrogênio possui uma hibridização sp³. Isto resulta em uma geometria molecular:
a) Linear
b) Trigonal plana
c) Angular
d) Piramidal trigonal
Resposta: alternativa D.
O átomo de nitrogênio na amônia possui 4 nuvens eletrônicas ao seu redor: 3 ligantes (com os átomos de H) e 1 par de elétrons não ligante.
Esse arranjo com 4 nuvens eletronicas (3 ligações e 1 par de elétrons não ligante) prevê uma geometria tetraédrica. No entanto, a geometria molecular considera apenas a posição dos átomos. A presença do par não ligante distorce a estrutura, resultando em uma geometria molecular piramidal trigonal.
Questão 3
Qual molécula é apolar, apesar de possuir ligações polares?
a) HCl
b) H₂O
c) CO₂
d) NH₃
Resposta: alternativa C.
O CO₂ possui uma geometria linear (O=C=O). Os momentos dipolares das duas ligações C=O, que são polares, são de mesma magnitude, mas atuam em sentidos opostos (no sentido dos oxigênios). Como a molécula é linear, esses vetores se cancelam perfeitamente, resultando em um momento dipolar total igual a zero, caracterizando uma molécula apolar.
As outras moléculas possuem geometrias que impedem o cancelamento total dos dipolos: (A) linear com 2 átomos, (B) angular, (D) pirâmide trigonal.
Questão 4
A Teoria da Ligação de Valência (TLV) explica a formação da ligação covalente através do:
a) Espalhamento de elétrons em bandas de energia.
b) Cruzamento de orbitais moleculares.
c) Overlap (sobreposição) de orbitais atômicos.
d) Atração iônica entre partes da molécula.
Resposta: alternativa C.
A Teoria da Ligação de Valência postula que uma ligação covalente se forma quando os orbitais atômicos de dois átomos se sobrepõem (overlap), permitindo que um par de elétrons com spins opostos seja compartilhado na região de sobreposição. O cruzamento de orbitais moleculares (B) é da Teoria dos Orbitais Moleculares (TOM).
Questão 5
Quantas ligações sigma (σ) e pi (π) existem, respectivamente, em uma molécula de nitrogênio (N₂)?
a) 1 σ e 1 π
b) 1 σ e 2 π
c) 2 σ e 1 π
d) 3 σ e 0 π
Resposta: alternativa B.
A tripla ligação na molécula de N₂ (N≡N) é composta por uma ligação sigma (σ) e duas ligações pi (π). A primeira ligação formada é sempre uma ligação sigma, e as ligações subsequentes (que compõem a dupla ou tripla ligação) são ligações pi.
Questão 6
De acordo com a Teoria da Repulsão dos Pares Eletrônicos da Camada de Valência (TRPECV), uma molécula com 2 átomos ligantes e 2 pares de elétrons não ligantes no átomo central terá uma geometria molecular:
a) Tetraédrica
b) Trigonal plana
c) Piramidal trigonal
d) Angular
Resposta: alternativa D.
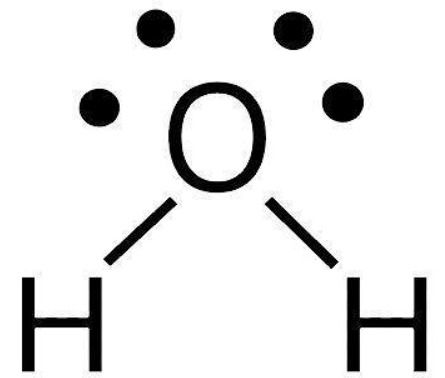
Uma molécula com um total de 4 nuvens eletrônicas (2 ligantes + 2 pares não ligantes) ao redor do átomo central tem uma geometria eletrônica tetraédrica.
Quando se considera a geometria molecular (a posição apenas dos átomos), a presença de 2 pares não ligantes faz com que a molécula adquire a forma angular (ex.: H2O).
Questão 7
Qual das seguintes moléculas apresenta ligação covalente dativa (coordenada)?
a) Cl₂
b) HCl
c) H₂O
d) NH₄⁺
Resposta: alternativa D.
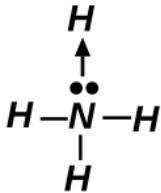
No íon amônio (NH₄⁺), o átomo de nitrogênio possui um par de elétrons disponível. Ele doa este par para um íon H⁺ (que não possui elétrons), formando uma ligação na qual os dois elétrons do par compartilhado são fornecidos pelo mesmo átomo.
Esta é a definição de uma ligação covalente dativa ou coordenada. Nas outras moléculas, os pares de elétrons são compartilhados de forma "comum", com um elétron vindo de cada átomo.
Continue praticando com
exercícios de ligações químicas (com respostas explicadas)
exercícios sobre ligações iônicas (com gabarito explicado)
exercícios sobre ligação metálica (com gabarito explicado).
ALVES, Gustavo. Exercícios sobre ligação covalente (com respostas explicadas). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-ligacao-covalente-com-respostas-explicadas/. Acesso em:


