Lei de Boyle
A lei de Boyle, também chamada de lei de Boyle-Mariotte, refere-se as transformações isotérmicas em um gás ideal, isto é, transformações que ocorrem com a temperatura constante.
Esta lei pode ser enunciada como:
Em uma transformação isotérmica o volume será inversamente proporcional à pressão, ou seja, o produto do volume pela pressão será igual a um valor constante.
Esta conclusão foi concebida de forma independente pelo químico e físico irlandês Robert Boyle (1627-1691) e pelo químico francês Edme Mariotte (1620-1684).
Quando um gás real está submetido a valores baixos de pressão e elevada temperatura, seu comportamento termodinâmico se aproxima de um gás ideal, podendo, desta forma, ser aplicada a lei de Boyle.
Fórmula
De acordo com a lei de Boyle, considerando a temperatura constante em uma transformação gasosa, temos a seguinte relação:
pV = K
Sendo,
p: pressão (N/m2)
V: volume (m3)
K: um valor constante
Essa relação pode ainda ser escrita considerando dois estados distintos de um mesmo gás:
p1V1 = p2V2
Exemplo
Um gás ideal está submetido a uma pressão de 1,5 atm. Mantendo-se a temperatura constante, qual o valor da pressão que deverá ficar submetido para que seu volume dobre?
Solução
Como é um gás ideal e a transformação indicada é uma isotérmica, podemos aplicar a lei de Boyle. Vamos chamar o volume inicial de V. Assim, temos:
Portanto, a pressão deverá ser igual a 0,75 atm para que o volume do gás dobre de valor.
Gráfico
Podemos representar uma transformação isotérmica através de um gráfico da variação da pressão em função do volume. Como existe uma proporção inversa entre essas duas grandezas, o gráfico será uma hipérbole.
A curva obtida é chamada de isoterma e representa o comportamento do volume e da pressão de um gás para uma dada temperatura.
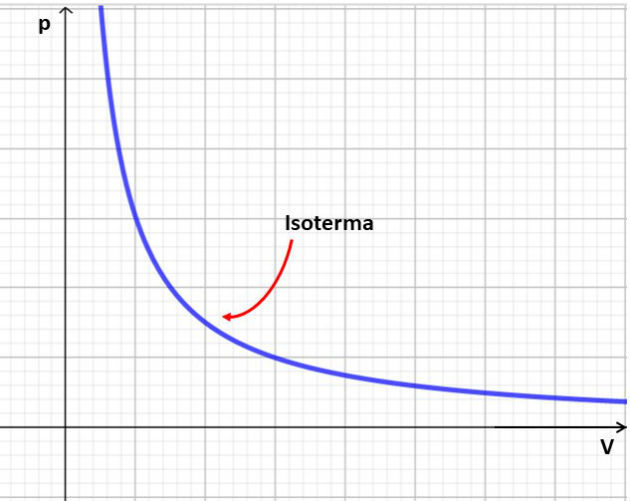
Note que o gráfico mostra uma variação contrária entre as grandezas, ou seja, quando o volume aumenta a pressão diminui.
Exercícios Resolvidos
1) UFRGS - 2017
Considere que certa quantidade de gás ideal, mantida a temperatura constante, está contida em um recipiente cujo volume pode ser variado. Assinale a alternativa que melhor representa a variação da pressão (p) exercida pelo gás, em função da variação do volume (V) do recipiente.
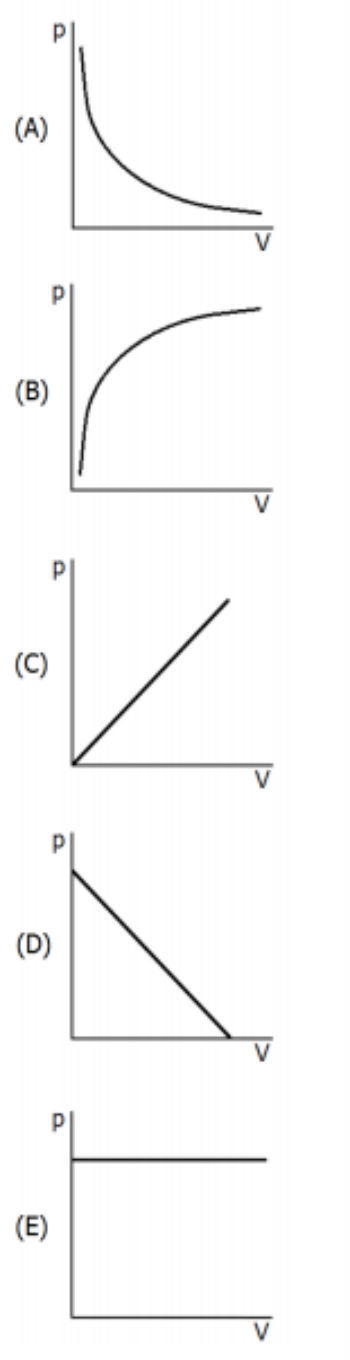
2) PUC/RJ - 2017
Um pequeno balão esférico flexível, que pode aumentar ou diminuir de tamanho, contém 1,0 litro de ar e está, inicialmente, submerso no oceano a uma profundidade de 10,0 m. Ele é lentamente levado para a superfície, a temperatura constante. O volume do balão (em litros), quando este atinge a superfície, é
Dados: patm =1,0 x 105 Pa ; ρágua = 1,0 x 103 kg/m3 ; g = 10 m/s2
a) 0,25
b) 0,50
c) 1,0
d) 2,0
e) 4,0
3) Unicamp - 2017
Fazer vácuo significa retirar o ar existente em um volume fechado. Esse processo é usado, por exemplo, para conservar alimentos ditos embalados a vácuo ou para criar ambientes controlados para experimentos científicos. A figura abaixo representa um pistão que está sendo usado para fazer vácuo em uma câmara de volume constante Vc = 2,0 litros. O pistão, ligado à câmara por uma válvula A, aumenta o volume que pode ser ocupado pelo ar em Vp = 0,2 litros. Em seguida, a válvula A é fechada e o ar que está dentro do pistão é expulso através de uma válvula B, ligada à atmosfera, completando um ciclo de bombeamento. Considere que o ar se comporte como um gás ideal e que, durante o ciclo completo, a temperatura não variou. Se a pressão inicial na câmara é de Pi = 33 Pa, a pressão final na câmara após um ciclo de bombeamento será de
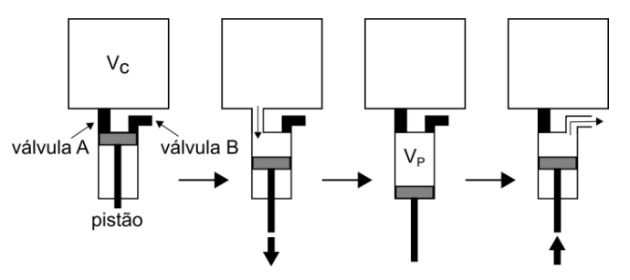
a) 30,0 Pa.
b) 330,0 Pa.
c) 36,3 Pa.
d) 3,3 Pa.
Leia também sobre:
GOUVEIA, Rosimar. Lei de Boyle. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/lei-de-boyle/. Acesso em:


