Transformação isobárica
A transformação isobárica corresponde às mudanças que ocorrem nos gases à pressão constante.
No estudo dos gases há três propriedades importantes: a pressão, a temperatura e o volume.
Em determinado instante, as medidas destas três grandezas compreendem o estado do gás, ao alterar ao menos uma, diz-se que o gás passou para outro estado.
As mudanças entre dois estados onde a pressão não muda e chamada transformação isobárica.
Nessas transformações, a relação entre volume e temperatura é sempre igual. Ou seja, ao dividir o volume pela temperatura, obtemos um mesmo valor numérico.
Não importa por quantas transformações o gás passe, se elas acontecem a mesma pressão, o valor obtido na divisão entre volume e temperatura, é sempre o mesmo.
A lei que rege esta transformação é a Lei de Charles e Gay-Lussac. Os cientistas Jacques Alexandre Charles e Joseph Louis Gay-Lussac através de seus experimentos chegaram a conclusão que:
“Se a pressão de uma massa de gás é constante, então a razão entre volume e temperatura também são constantes.”
Como ocorre a Transformação Isobárica?
O prefixo iso indica que a grandeza é constante. Portanto, no processo isobárico a pressão é mantida constante ao realizar uma transformação.
- p é a pressão;
- V é o volume, medido em m³ (metro cúbico) ou l (litros);
- T é a temperatura, medida em K (Kelvin).
Isto significa que se um gás passa por sucessivas mudanças à pressão constante, o quociente entre volume e temperatura é o mesmo.
Fórmula da Transformação Isobárica
Matematicamente, em qualquer estado, a transformação isobárica é expressa através da fórmula:
O K representa o valor numérico igual nas três transformações.
Onde,
V: volume ocupado pelo gás;
T: temperatura absoluta do gás;
K: constante de pressão, que relaciona massa, pressão e natureza do gás.
Os índices (1, 2, 3) se referem aos estados.
Exemplo
Um cilindro contém 2 litros de um gás a uma temperatura de 27°C. Se o gás sofre uma transformação isobárica e a temperatura se eleva para 127°C, determine o volume final do gás.
Dados:
- Volume inicial (V₁) = 2 litros
- Temperatura inicial (T₁) = 27°C
- Temperatura final (T₂) = 127°C
- A transformação é isobárica, ou seja, a pressão se mantém constante.
A fórmula da lei de Charles é:
Onde:
- V1 = Volume inicial
- T1 = Temperatura inicial
- V2 = Volume final
- T2 = Temperatura final
Para transformar as temperaturas de Cº para K, somamos 273,15.
T1 = 27 + 273,15 = 300,15 K
T2 = 127 + 273,15 = 400,15 K
Substituindo os valores conhecidos na fórmula:
Resolvendo para V2:
Assim, o volume final será de, aproximadamente, 2,66 l.
Outra forma de interpretarmos a relação entre as grandezas da Lei de Charles e Gay-Lussac é dizer que uma massa de gás submetida a uma transformação à pressão constante tem a variação de volume diretamente proporcional à variação de temperatura.
Portanto, a variação ocorre uniformemente: se dobrarmos uma grandeza, a outra aumenta na mesma proporção. Da mesma forma, se reduzirmos pela metade, a outra igualmente diminui.
Em uma expansão isobárica ocorre o aumento do volume do gás, já na compressão isobárica há a diminuição do volume do gás.
Gráficos da Transformação Isobárica
Relacionando as grandezas volume e temperatura, o gráfico é apresentado como um segmento de reta.
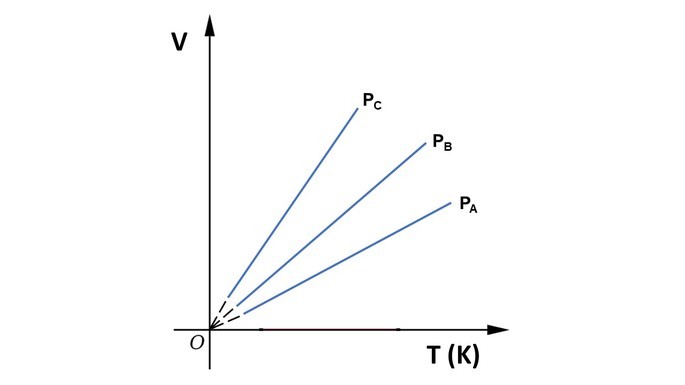
Se utilizarmos o diagrama para comparar três pressões diferentes de um mesmo gás, onde pa > pb > pc , a constante na relação é inversamente proporção à pressão e, por isso, ka < kb < kc. Portanto, a maior pressão apresenta a menor constante.
Através do gráfico com as grandezas volume e pressão é possível calcular o trabalho na transformação isobárica.
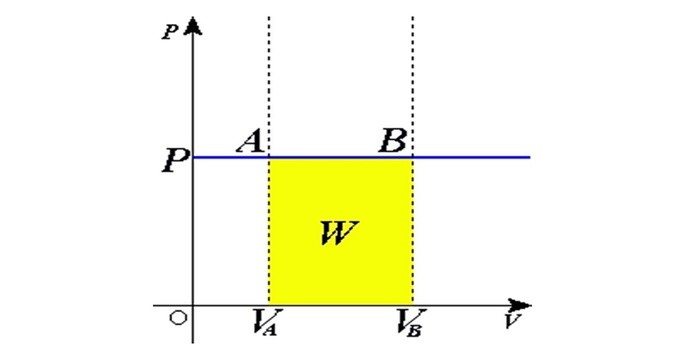
Cálculo do trabalho em uma transformação isobárica
A área da figura corresponde ao trabalho, que pode ser calculada por:
Onde,
W: trabalho;
p: pressão constante;
: variação de volume.
Saiba mais sobre as Transformações Gasosas.
Exercícios sobre Transformações Isobáricas
Questão 1
Em uma transformação isobárica um gás que preenche um recipiente de 3,0 l e está inicialmente com uma temperatura de 450 K. O estado final do gás indica que sua temperatura diminuiu para 300 K. Qual o volume do gás ao término da transformação?
a) 1,0 l
b) 2,0 l
c) 3,0 l
d) 4,0 l
Questão 2
Um gás sofreu uma transformação à pressão constante e, como resultado, seu volume aumentou 80%. Sabendo que no estado inicial a massa de gás estava nas CNTP (condições normais de temperatura e pressão), determine a temperatura do gás, em graus Celsius, após este processo.
Dados:
a) 198,6 ºC
b) 186,4 ºC
c) 228,6 ºC
d) 218,4 ºC
Continue seus estudos lendo também sobre:
Referências Bibliográficas
ÇENGEL, Y.A.; BOLES, M. A. Termodinâmica. 7 ed. Porto Alegre : AMGH, 2013.
HELOU; GUALTER; NEWTON. Tópicos de Física, vol. 2. São Paulo: Editora Saraiva, 2007.
ASTH, Rafael. Transformação isobárica. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/transformacao-isobarica/. Acesso em:


