Peróxido de hidrogênio
O peróxido de hidrogênio é uma substância química formada por 2 átomos de hidrogênio e 2 átomos de oxigênio, cuja fórmula é H2O2.
Pode-se dizer que é uma molécula de água com um oxigênio a mais. Foi descoberto em 1818, pelo cientista Louis Auguste Thenard.
Dos compostos da classe dos peróxidos, o peróxido de hidrogênio é o mais simples e amplamente utilizado. Suas aplicações vão desde um antisséptico, na forma de solução conhecida como água oxigenada, até a propulsão de foguetes, utilizando-o de maneira concentrada.
Fórmula do peróxido de hidrogênio
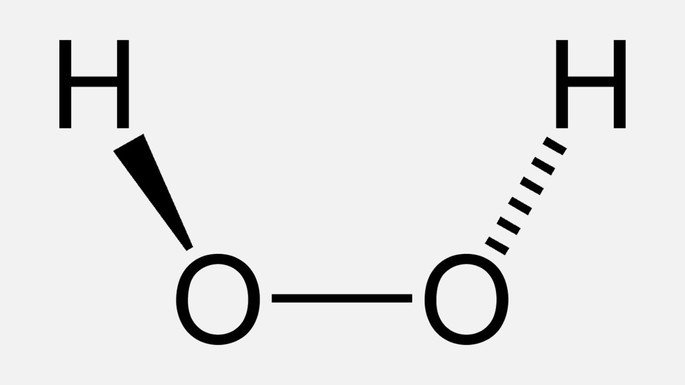
Na imagem acima, podemos ver a ligação simples O-O, que corresponde ao grupo peróxido do composto.
A reatividade da substância provém dessa ligação oxigênio-oxigênio, que é altamente instável.
Ao desfazer-se a ligação, na ausência de outras substâncias, ocorre uma reação de decomposição, onde há a formação dos gases oxigênio e hidrogênio.
Aplicações do peróxido de hidrogênio
Antes de ver os principais usos, lembre-se de ao utilizar o produto ler o rótulo e seguir as instruções de manuseio com as devidas precauções.
Antisséptico
Geralmente, vemos a indicação de uso da água oxigenada para assepsia de ferimentos, como cortes e queimaduras (a região afetada deve estar limpa antes de usar). Além disso, também é utilizado, misturado com água, como enxaguante bucal.
Ao entrar em contato com a pele, a enzima catalase degrada o peróxido de hidrogênio, pois essa substância é tóxica para as células.
O poder antisséptico deve-se a liberação de oxigênio quando a solução é inserida na área desejada. A formação do gás é percebida pelo aparecimento de espuma, que ajuda a limpar e remover a pele morta.
Cuidado! Não é recomendado a utilização sob ferimentos profundos, mordidas de animais, queimaduras de graus elevados ou a ingestão do produto.
Branqueador
A primeira aplicação encontrada para o peróxido de hidrogênio foi a de descolorante, por volta de 1900, sendo aplicado em chapéus de palha.
Industrialmente, é utilizado como alvejante para têxteis. Muitos materiais, como lã, seda e algodão, podem ser branqueados pela ação do peróxido.
Descolorante capilar
Como descolorante de cabelo, o peróxido ao ligar-se com a molécula de pigmento que produz a cor faz com que ela não reflita a luz como antes, fazendo com que visualmente perceba-se um clareamento.
A sua utilização para alterar a cor dos fios tornou-se uma das mais comuns, principalmente pela utilização de famosas, como Marilyn Monroe, que obtinham fios platinados utilizando uma mistura com peróxido.
Propulsor de foguetes
Para fazer decolar foguetes e torpedos, o peróxido de hidrogênio é utilizado para oxidar o combustível hidrazina (N2H4), fazendo com que haja uma reação quase instantânea e a propulsão do foguete pela produção de vapor e oxigênio.
Peróxido de hidrogênio e a água oxigenada
Uma solução de peróxido de hidrogênio é comercializada com o nome de água oxigenada. O peróxido de hidrogênio é um poderoso oxidante, pois é capaz de se decompor rapidamente em contato com água ou ar, por isso uma solução diluída entre 3%-9% é vendida para uso doméstico.
No rótulo da água oxigenada que encontramos nas farmácias vemos a informação, por exemplo, 10 volumes. Isto quer dizer que 10 mL do gás oxigênio são produzidos por 1 mL de peróxido de hidrogênio.
A água oxigenada é vendida em recipientes plásticos ou em vidros escuros, pois o peróxido de hidrogênio pode se decompor facilmente na presença de metais se for exposto à luz solar.
Propriedades do peróxido de hidrogênio
- Massa molar: 34,015 g/mol
- Densidade: 1,45 g/cm3
- Ponto de ebulição: 150,02 ºC
- Ponto de fusão: – 0,43 ºC
- É miscível com a água, formando uma solução homogênea. Também é solúvel em solventes orgânicos, como o éter.
- Apesar de ser um forte agente oxidante, pode atuar como agente redutor se a substância com que reage tiver maior poder de oxidação.
Características do peróxido de hidrogênio
Trata-se de um ácido fraco, oxidante, corrosivo, irritante, com odor característico e sabor amargo. Embora não seja inflamável, pode reagir com combustíveis por ser um forte oxidante.
No estado puro, apresenta-se como um líquido levemente viscoso, com coloração azul muito claro, mas por ser comercializado na forma de solução aquosa, por questões de segurança, aparenta ser incolor.
Fabricação do peróxido de hidrogênio
A produção desse composto químico possui diferentes rotas de processo, podendo ser realizada em laboratório, em menores quantidades, ou industrialmente.
A reação de compostos orgânicos, como antraquinona ou álcool isopropílico, com o oxigênio do ar são as mais comuns formas de fabricação.
Confira a seguir duas reações químicas em que o peróxido de hidrogênio é formado.
Reação I: Reação do peróxido de bário hidratado com ácido sulfúrico
Para que a reação ocorra o peróxido de bário é acidificado e a água é removida por evaporação à pressão reduzida. Esse método produz peróxido de hidrogênio com concentração de 5%.
Reação II: Reação do peróxido de sódio com ácido sulfúrico
A utilização de ácido sulfúrico diluído para dissolver o peróxido de bário faz com que se obtenha uma solução concentrada de 30% de peróxido de hidrogênio.
Para complementar sua leitura, veja também os textos a seguir:
- Catalase e degradação do peróxido de hidrogênio
- Óxidos: o que são, classificação e exemplos
- Funções inorgânicas
BATISTA, Carolina. Peróxido de hidrogênio. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/peroxido-de-hidrogenio/. Acesso em:


