Substâncias puras e misturas
Uma substância pura é formada por um único tipo de espécie química, ou seja, sua composição e propriedades são fixas. Uma mistura contém mais de um tipo de componente e, por isso, sua organização é variável.
Dessa forma, só podemos distinguir uma substância pura de uma mistura ao conhecermos sua composição.
Ao compararmos um copo com água e um copo com açúcar dissolvido, nossos olhos não percebem nenhuma diferença. Entretanto, se ingerirmos o conteúdo dos dois copos notaremos que um é a substância pura e o outro é constituído de uma mistura.
Substâncias puras
Uma substância pura é o conjunto de apenas uma espécie química, ou seja, ela não está misturada com outras.
Vamos utilizar a água como exemplo. A água (H2O) é reconhecida por suas características e as propriedades específicas desse material nos ajudam a identificá-lo. As principais propriedades da água são:
| Densidade | 1,00 g/cm3 |
|---|---|
| Ponto de fusão | 0 ºC |
| Ponto de ebulição | 100 ºC |
Quando um material possui propriedades fixas e invariáveis em toda a sua extensão, dizemos que se trata de uma substância pura.
Ao colocarmos sal de cozinha, o cloreto de sódio (NaCl), dentro de um copo com água e mexermos ocorrerá uma mudança.
O resultado é um produto com densidade intermediária entre a da água e do sal. Isso ocorre porque a água deixou de ser uma substância pura e se tornou uma mistura.
Ao tentar congelar essa mistura, você perceberá que a temperatura de fusão será menor que 0 ºC e que também essa mistura não entrará em ebulição à 100 ºC, mais calor será necessário para evaporar esse produto.
Substâncias puras simples e compostas
As substâncias puras são classificadas como simples quando em sua composição há átomos de apenas um elemento químico.
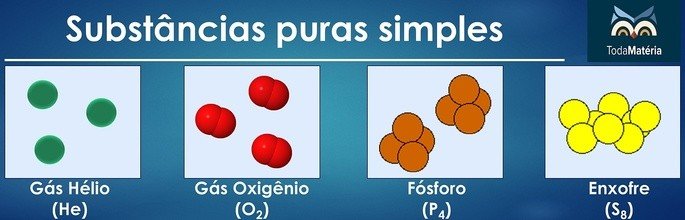
O arranjo de átomos de dois ou mais elementos químicos formam as substâncias puras compostas.

Misturas
Uma mistura corresponde a junção de duas ou mais substâncias puras, que são chamadas de componentes.
Ao contrário das substâncias puras, suas propriedades não são fixas, pois dependem da proporção dos componentes na mistura.
Veja como a densidade, uma propriedade física, varia conforme a quantidade de sal misturado com a água.
| Porcentagem de sal na massa total da mistura |
Densidade da mistura (g/cm3) a 20 °C |
|---|---|
| 1 | 1,005 |
| 8 | 1,056 |
| 12 | 1,086 |
| 16 | 1,116 |
| 26 | 1,197 |
Fonte: FURNISS, B. S. et al. Vogel’s Textbook of Practical Organic Chemistry. 4. ed. Londres: Longman, 1987. p. 1.312.
Sendo assim, a adição de água e sal, em qualquer proporção, possui densidade variável e, por isso, não podemos classificar a mistura nem como água nem como sal.
Misturas homogêneas e heterogêneas
Misturas homogêneas são aquelas que apresentam os componentes em apenas uma fase e, por isso, as mesmas propriedades em todos os seus pontos.
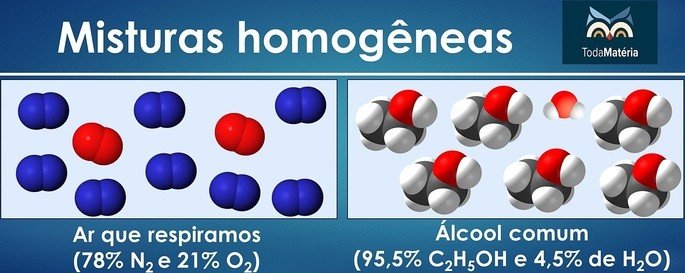
Quando visualmente percebemos mais de uma fase, então a mistura é classificada como heterogênea.

Resumo sobre substâncias puras e misturas
| Substâncias puras e misturas | ||
|---|---|---|
|
Sistema homogêneo (apenas uma fase) |
Substância pura (um só componente) |
|
|
Mistura homogênea (mais de um componente na mesma fase) |
||
|
Sistema heterogêneo (mais de uma fase) |
Substância pura (um componente em diferentes estados físicos) |
|
|
Mistura heterogênea (mais de um componente em mais de uma fase) |
||
Exercícios com gabarito comentado
1. (UFMG) Uma amostra de uma substância pura X teve algumas de suas propriedades determinadas. Todas as alternativas apresentam propriedades que são úteis para identificar essa substância, exceto:
a) densidade.
b) massa da amostra.
c) solubilidade em água.
d) temperatura de ebulição.
e) temperatura de fusão.
2. (Vunesp) O rótulo de uma garrafa de água mineral está reproduzido a seguir.
| Composição química provável: |
|---|
| Sulfato de cálcio 0,0038 mg/L |
| Bicarbonato de cálcio 0,0167 mg/L |
Com base nessas informações, podemos classificar a água mineral como:
a) substância pura.
b) substância simples.
c) mistura heterogênea.
d) mistura homogênea.
e) suspensão coloidal.
3. (UCDB) Em um laboratório de Química foram preparadas as seguintes misturas:
I. água /gasolina
II. água/sal
III. água/areia
IV. gasolina/sal
V. gasolina/areia
Quais dessas misturas são homogêneas?
a) Nenhuma.
b) Somente II.
c) II e III.
d) I e II.
e) II e IV.
4. (Ufes) Em um sistema, bem misturado, constituído de areia, sal, açúcar, água e gasolina, o número de fases é:
a) 2.
b) 3.
c) 4.
d) 5.
e) 6.
5. (Mackenzie) Constitui um sistema heterogêneo a mistura formada de:
a) cubos de gelo e solução aquosa de açúcar (glicose).
b) gases N2 e CO2.
c) água e acetona.
d) água e xarope de groselha.
e) querosene e óleo diesel.
Teste seus conhecimentos com os exercícios:
- Exercícios sobre substâncias e misturas (com gabarito comentado)
- Exercícios sobre misturas homogêneas e heterogêneas
- Exercícios sobre separação de misturas
- Questões sobre a Química e as Substâncias (com gabarito explicado)
BATISTA, Carolina. Substâncias puras e misturas. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/substancias-puras-e-misturas/. Acesso em:


