Isomeria
Isomeria química é um fenômeno observado quando duas ou mais substâncias orgânicas têm a mesma fórmula molecular, mas estrutura molecular e propriedades diferentes.
As substâncias químicas com essas características são denominadas isômeros.
O termo deriva das palavras gregas iso = igual e meros = partes, ou seja, partes iguais.
Existem diferentes tipos de isomeria:
- Isomeria plana: Os compostos são identificados através das fórmulas estruturais planas. Divide-se em isomeria de cadeia, isomeria de função, isomeria de posição, isomeria de compensação e isomeria de tautomeria.
- Isomeria espacial: A estrutura molecular dos compostos apresenta diferentes estruturas espaciais. Divide-se em isomeria geométrica e isomeria óptica.
Isomeria plana
Na isomeria plana ou isomeria constitucional, a estrutura molecular das substâncias orgânicas é plana.
Os compostos que apresentam essa característica são denominados de isômeros planos.
Isomeria de cadeia
A isomeria de cadeia acontece quando os átomos de carbono apresentam cadeias diferentes e a mesma função química.
Exemplos:
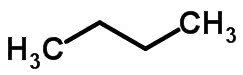
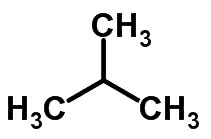
Isomeria de função
A isomeria de função ocorre quando dois ou mais compostos possuem funções químicas diferentes e a mesma fórmula molecular.
Exemplos: Esse caso é comum entre aldeídos e cetonas.

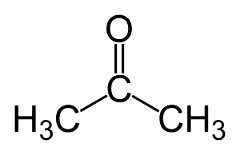
Isomeria de posição
A isomeria de posição ocorre quando os compostos diferenciam-se pelas diferentes posições de insaturação, ramificação ou grupo funcional na cadeia carbônica. Nesse caso, os isômeros apresentam a mesma função química.
Exemplos:
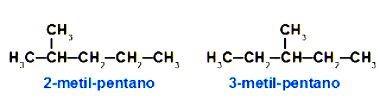
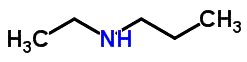
Isomeria de compensação
A isomeria de compensação ou metameria ocorre em compostos com a mesma função química que diferenciam-se pela posição dos heteroátomos.
Exemplos:
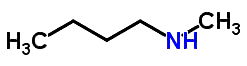
Tautomeria
A tautomeria ou isomeria dinâmica pode ser considerada um caso específico de isomeria de função. Nesse caso, um isômero pode transformar-se em outro pela mudança de posição de um elemento na cadeia.
Exemplos:
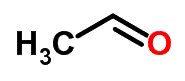

Isomeria espacial
A isomeria espacial, também chamada de estereoisomeria, acontece quando dois compostos têm a mesma fórmula molecular e diferentes fórmulas estruturais.
Nesse tipo de isomeria, os átomos estão distribuídos da mesma maneira, mas ocupam posições diferentes no espaço.
Isomeria geométrica
A isomeria geométrica ou cis-trans ocorre em cadeias abertas insaturadas e também em compostos cíclicos. Para tanto, os ligantes do carbono têm de ser diferentes.

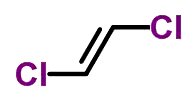
- Quando os mesmos ligantes encontram-se do mesmo lado, a nomenclatura do isômero recebe o prefixo cis.
- Quando os mesmos ligantes encontram-se em lados opostos, a nomenclatura recebe o prefixo trans.
A IUPAC (União Internacional de Química Pura e Aplicada) recomenda que em vez de cis e trans, sejam utilizadas as letras Z e E como prefixo.
Isso acontece porque Z é a primeira letra da palavra alemã zusammen, que significa "juntos". E é a primeira letra da palavra alemã entegegen, que significa "opostos".
Isomeria óptica
A isomeria óptica é demonstrada pelos compostos que são opticamente ativos. Ela acontece quando uma substância é provocada pelo desvio angular no plano de luz polarizada.
- Quando uma substância desvia a luz óptica para a direita é denominada dextrogira.
- Quando uma substância desvia a luz óptica para a esquerda, a substância é denominada levogira.
Uma substância pode existir, ainda, em duas formas que são opticamente ativas, dextogira e levogira. Nesse caso, ela é chamada de enantiômero.
Para que um composto de carbono seja opticamente ativo, deve ser quiral. Isso quer dizer que os seus ligantes não podem se sobrepor, sendo assimétricos.
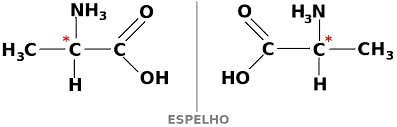
Por sua vez, se um composto apresenta as formas dextrogira e levogira em partes iguais, elas recebem o nome de misturas racêmicas. A atividade óptica das misturas racêmicas é inativa.
Leia também:
Exercícios
1. (Mackenzie 2012) Numere a coluna B, que contém compostos orgânicos, associando-os com a coluna A, de acordo com o tipo de isomeria que cada molécula orgânica apresenta.
Coluna A
1. Isomeria de compensação
2. Isomeria geométrica
3. Isomeria de cadeia
4. Isomeria óptica
Coluna B
( ) ciclopropano
( ) etóxi-etano
( ) bromo-cloro-fluoro-metano
( ) 1,2-dicloro-eteno
A sequência correta dos números da coluna B, de cima para baixo, é
a) 2 – 1 – 4 – 3.
b) 3 – 1 – 4 – 2.
c) 1 – 2 – 3 – 4.
d) 3 – 4 – 1 – 2.
e) 4 – 1 – 3 – 2.
2. (Uerj) Isomeria é o fenômeno que se caracteriza pelo fato de uma mesma fórmula molecular representar diferentes estruturas.
Considerando a isomeria estrutural plana para a fórmula molecular C4H8, podemos identificar os isômeros dos seguintes tipos:
a) cadeia e posição
b) cadeia e função
c) função e compensação
d) posição e compensação
3. (OSEC) A propanona e o isopropenol exemplificam um caso de Isomeria:
a) de metameria
b) de função
c) de tautomeria
d) cis-tran
e) de cadeia
Veja também: Exercícios sobre Isomeria Plana
MAGALHÃES, Lana. Isomeria. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/isomeria/. Acesso em:


