Exercícios sobre diagramas de fases (com gabarito explicado)
Os diagramas de fases são ferramentas fundamentais para entender como a matéria se comporta em diferentes temperaturas e pressões.
Nestes exercícios, você poderá praticar a interpretação de diagramas de água, benzeno, dióxido de carbono e hélio, aplicando conceitos de transições de fase, ponto triplo, ponto crítico e fluidos supercríticos. Cada questão vem com gabarito explicado, ajudando você a consolidar o aprendizado e se preparar de forma prática para o ENEM.
Questão 1
Durante uma expedição ao Pico da Bandeira, um grupo de montanhistas levou água em uma garrafa térmica especial com medidor de pressão e temperatura.
Ao longo do dia, eles observaram diferentes comportamentos da água conforme as condições mudavam. Elas estão resumidas como:
I. Na base da montanha: 25°C e 1 atm
II. No acampamento: 0°C e 0,5 atm
III. No pico (garrafa aberta): 0°C e 0,006 atm
IV. Experimento com bomba de vácuo: 25°C e 0,02 atm
Para entender o que estava acontecendo eles usaram um diagrama de fase da água, como o mostrado abaixo:
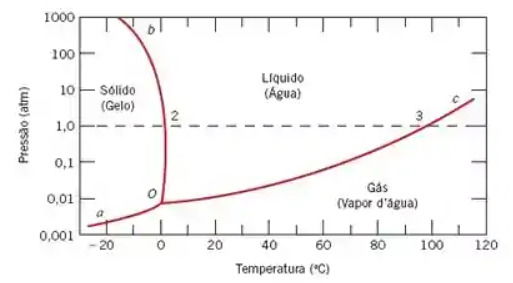
E as seguintes informações:
- Ponto triplo em 0°C e 0,006 atm;
- Três linhas se encontrando no ponto triplo.
Em qual(is) situação(ões) é possível observar a coexistência de três fases da água simultaneamente?
a) Apenas na situação I, pois está em temperatura ambiente.
b) Apenas na situação II, pois está a 0°C.
c) Apenas na situação III, pois está exatamente no ponto triplo.
d) Nas situações II e III, pois ambas estão a 0°C.
Resposta correta: alternativa c) Apenas na situação III, pois está exatamente no ponto triplo.
Vamos analisar cada situação:
Situação I : 25°C e 1 atm - Ponto localizado na região da água líquida - apenas uma fase presente.
Situação II : 0°C e 0,5 atm - Ponto sobre a linha de fusão - coexistem apenas gelo e água líquida (duas fases).
Situação III : 0°C e 0,006 atm - Este é exatamente o ponto triplo da água, único ponto onde as três fases (sólido, líquido e vapor) coexistem em equilíbrio.
Situação IV : 25°C, 0,02 atm - Ponto localizado na região do vapor - apenas uma fase presente.
O ponto triplo é único e ocorre em condições muito específicas de temperatura e pressão.
Questão 2
Muitas pessoas utilizam a panela de pressão para cozinhar alimentos como feijão e carnes em menos tempo.
O princípio de funcionamento é simples: a panela é um recipiente hermeticamente fechado que, ao ser aquecido, aprisiona o vapor dʼágua.
O acúmulo de vapor aumenta a pressão interna para valores significativamente maiores que a pressão atmosférica normal.
Para entender cientificamente por que isso acelera o cozimento, é preciso analisar o diagrama de fases da água, que relaciona pressão, temperatura e os estados físicos da matéria.
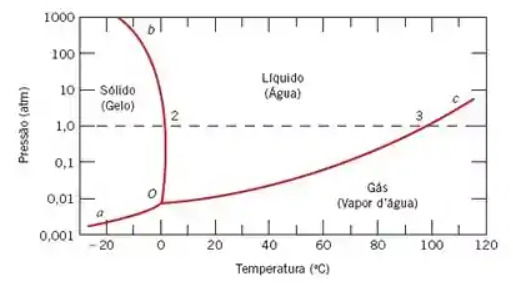
Com base no diagrama e no funcionamento da panela de pressão, qual alternativa explica corretamente por que os alimentos cozinham mais rapidamente nela?
a) A pressão alta comprime as fibras do alimento, amolecendo-as diretamente, sem que a temperatura seja o fator principal.
b) Ao aumentar a pressão interna para cerca de 2 atm, a panela eleva a temperatura de ebulição da água para aproximadamente 120°C, fazendo com que o calor seja transferido ao alimento de forma mais intensa.
c) A panela, por ser selada, impede que o vapor escape, fazendo com que o alimento cozinhe no seu próprio suco, o que é mais eficiente que cozinhar em água.
d) O aumento da pressão interna reduz a temperatura necessária para a água ferver, economizando energia e cozinhando o alimento com menos calor.
Resposta correta: alternativa b) Ao aumentar a pressão interna para cerca de 2 atm, a panela eleva a temperatura de ebulição da água para aproximadamente 120°C, fazendo com que o calor seja transferido ao alimento de forma mais intensa.
A alternativa b) é a única que interpreta corretamente o diagrama e o fenômeno.
O diagrama mostra que a linha de equilíbrio líquido-gás tem uma inclinação positiva.
Em uma panela aberta, a pressão é de 1 atm e a água ferve a 100°C.
Na panela de pressão, o aumento da pressão para cerca de 2 atm força a água a ferver em uma temperatura mais alta, em torno de 120°C.
Como as reações químicas do cozimento são mais rápidas em temperaturas mais elevadas, o alimento cozinha em menos tempo.
As outras alternativas apresentam erros conceituais:
- a pressão não cozinha o alimento diretamente - alternativa a);
- a eficiência do vapor é um fator, mas não o principal - alternativa c);
- e a pressão aumenta, não reduz, a temperatura de ebulição - alternativa d)
Questão 3
Em uma indústria química, um processo de purificação de benzeno (C₆H₆) envolve a cristalização fracionada, onde o benzeno líquido é resfriado lentamente até começar a solidificar.
Um engenheiro, lembrando-se do fenômeno da patinação no gelo (onde a pressão da lâmina derrete o gelo), sugere aplicar alta pressão ao sistema.
Ele argumenta que isso diminuiria a temperatura de congelamento do benzeno, permitindo que a solidificação ocorra a uma temperatura mais baixa e economizando energia com refrigeração.
Para avaliar a proposta, um técnico consulta o diagrama de fases do benzeno, apresentado abaixo:
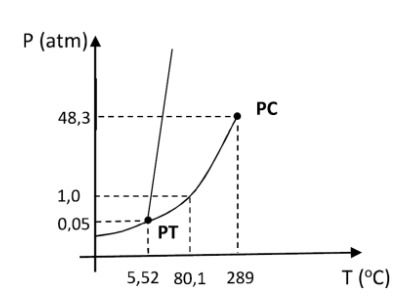
Onde PT é o ponto triplo e PC é o ponto crítico.
Analisando o diagrama de fases do benzeno, qual é a consequência termodinâmica da proposta do engenheiro?
a) A hipótese do engenheiro está incorreta; o diagrama mostra que a linha de equilíbrio sólido-líquido tem inclinação positiva, significando que um aumento de pressão, na verdade, eleva a temperatura de congelamento.
b) A proposta é viável, pois o benzeno, assim como a água, é uma substância anômala cujo sólido é menos denso que o líquido, fazendo com que a pressão facilite a fusão.
c) Ao aplicar alta pressão, o sistema se aproximaria do Ponto Triplo, onde a coexistência das três fases tornaria o processo de purificação por cristalização impossível.
d) A proposta só funcionaria se a pressão fosse alta o suficiente para levar o benzeno ao estado supercrítico, onde a cristalização ocorre de forma mais controlada.
Resposta correta: alternativa a) A hipótese do engenheiro está incorreta; o diagrama mostra que a linha de equilíbrio sólido-líquido tem inclinação positiva, significando que um aumento de pressão, na verdade, eleva a temperatura de congelamento.
A alternativa a) está correta.
A principal diferença entre o diagrama de fases do benzeno e o da água é a inclinação da linha de equilíbrio sólido-líquido.
No benzeno (e na maioria das substâncias), essa linha tem inclinação positiva. Isso significa que, para uma maior pressão, é necessária uma maior temperatura para que a fusão ocorra (ou seja, o ponto de congelamento aumenta com a pressão).
A hipótese do engenheiro foi baseada em uma analogia incorreta com a água, que tem uma linha de equilíbrio sólido-líquido com inclinação negativa.
Observe o diagrama de fases da água:
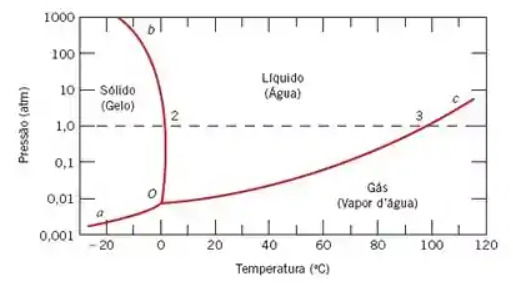
As linhas de separação de fase sólido-líquido da água e do benzeno possuem inclinações opostas.
Portanto, aplicar pressão tornaria o congelamento mais difícil, não mais fácil.
Questão 4
Um alpinista, ao acampar no cume do Pico da Neblina, a quase 3.000 metros de altitude, percebe um fenômeno curioso ao tentar cozinhar macarrão.
Ele nota que a água em sua panela ferve muito mais rápido do que ao nível do mar. No entanto, mesmo após deixar o macarrão cozinhando por mais tempo que o usual, a massa continua dura.
Para entender o ocorrido, ele consulta um manual de montanhismo que apresenta um diagrama de fases simplificado da água, mostrando a temperatura de ebulição em diferentes pressões atmosféricas.
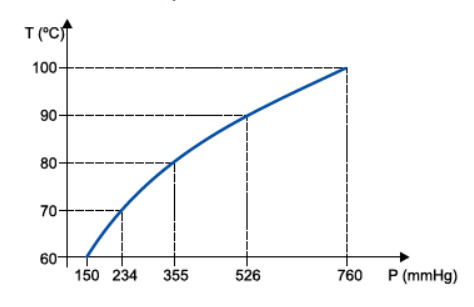
A pressão no cume é de aproximadamente 0,7 atm ou 532 mmHg.
Qual alternativa, com base no diagrama de fases da água, explica corretamente a dificuldade do alpinista?
a) A menor pressão atmosférica (0,7 atm) dificulta a transferência de calor do fogo para a panela, fazendo a água ferver apenas superficialmente.
b) Em altitudes elevadas, a água evapora mais facilmente, mas não consegue atingir a temperatura de ebulição (100°C) necessária para o cozimento.
c) Quando a pressão é de 0,7 atm, a água entra em ebulição aproximadamente a 90°C, ou seja, em uma temperatura mais baixa do que os 100°C do nível do mar, sendo insuficiente para cozinhar o macarrão no tempo normal.
d) A baixa pressão faz com que a água ferva a uma temperatura superior a 100°C, mas o ar rarefeito dissipa o calor rapidamente, impedindo o cozimento.
Resposta correta: alternativa c) Quando a pressão é de 0,7 atm, a água entra em ebulição aproximadamente a 90°C, ou seja, em uma temperatura mais baixa do que os 100°C do nível do mar, sendo insuficiente para cozinhar o macarrão no tempo normal.
A alternativa c) oferece a explicação correta e completa.
O gráfico mostra que, ao diminuir a pressão (de 1 atm para 0,7 atm), a temperatura na qual a água ferve também diminui (de 100°C para 90°C).
Embora a água esteja fervendo (mudando de fase), ela o faz a uma temperatura mais baixa.
Muitos processos químicos do cozimento, como a gelatinização do amido no macarrão, dependem de uma temperatura próxima a 100°C para ocorrerem de forma eficiente.
A 90°C, esse processo é muito mais lento, resultando em um macarrão que parece não cozinhar direito.
Questão 5
A liofilização, ou secagem a frio, é um processo de desidratação sofisticado usado para preservar alimentos perecíveis, como frutas para cereais matinais, café solúvel e até mesmo vacinas.
O processo consiste em congelar o produto e, em seguida, submetê-lo a um vácuo intenso.
Nessas condições, o gelo contido no produto não derrete, mas sublima, passando diretamente do estado sólido para o gasoso, preservando a estrutura, o sabor e os nutrientes do material original.
O diagrama de fases da água, substância majoritária na maioria dos alimentos, é fundamental para entender a liofilização.
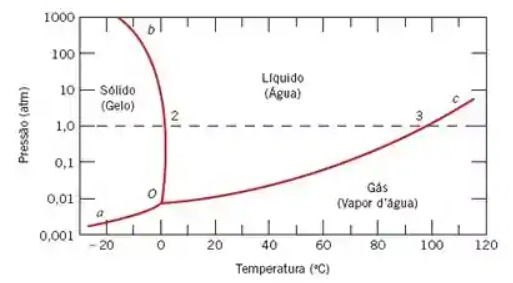
Onde 0 representa o ponto triplo da água. O gráfico mostra os valores de temperatura e pressão que possibilitam a presença concomitante dos três estados da água, a saber: sólido, líquido e gasoso.
Para que o processo de liofilização ocorra com sucesso, a amostra congelada deve ser submetida a uma trajetória de mudança de estado que corresponde a qual das seguintes opções?
a) Aumentar a pressão para acima de 1 atm e aquecer a amostra, forçando a fusão do gelo antes da evaporação.
b) Levar a amostra exatamente às condições do Ponto Triplo (0.006 atm e 0.01°C), onde as três fases coexistem em equilíbrio.
c) Manter a pressão em 1 atm e aquecer a amostra de -10°C até 20°C, permitindo que o gelo derreta e a água evapore naturalmente.
d) Reduzir a pressão para um valor abaixo do Ponto Triplo e, em seguida, aquecer suavemente a amostra, mantendo a baixa pressão.
Resposta correta: alternativa d) Reduzir a pressão para um valor abaixo do Ponto Triplo e, em seguida, aquecer suavemente a amostra, mantendo a baixa pressão.
A alternativa d) descreve perfeitamente o processo de liofilização.
Para que ocorra a sublimação (passagem direta de sólido para gás), é necessário evitar a fase líquida.
Olhando para o diagrama, a única maneira de passar da região "SÓLIDO" para a região "GÁS" sem cruzar a região "LÍQUIDO" é operando a uma pressão inferior à do Ponto Triplo (0.006 atm).
O processo consiste em congelar o material (iniciando na região "SÓLIDO") e depois reduzir a pressão para abaixo de 0.006 atm.
Em seguida, um leve aquecimento fornece a energia necessária para que as moléculas de água sublimem, sendo removidas na forma de vapor.
Questão 6
A indústria alimentícia moderna utiliza dióxido de carbono (CO₂) em estado supercrítico para descafeinar grãos de café.
Um fluido supercrítico é um estado da matéria que existe acima de sua temperatura e pressão críticas, exibindo propriedades intermediárias entre um líquido (dissolve substâncias como um solvente) e um gás (preenche o recipiente e penetra nos sólidos).
Esse método é vantajoso por ser seletivo, removendo a cafeína sem extrair os compostos que dão sabor e aroma ao café.
O diagrama de fases simplificado do dióxido de carbono é mostrado abaixo:
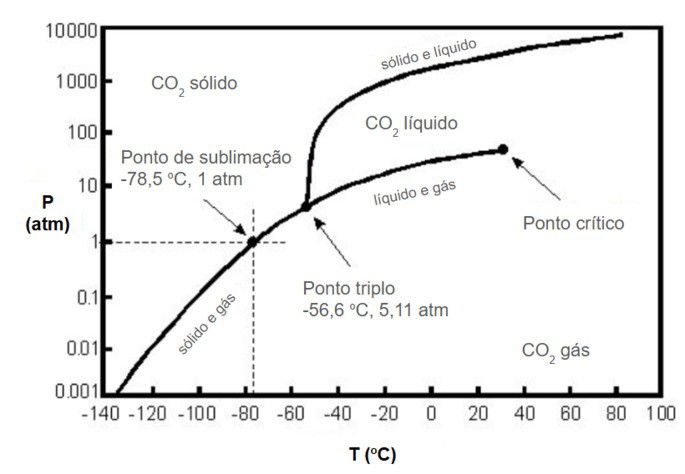
Com base no diagrama e na descrição do processo, qual conjunto de condições (pressão e temperatura) seria adequado para realizar a descafeinação supercrítica do café?
a) P = 1 atm e T = -78°C
b) P = 60 atm e T = 0°C
c) P = 100 atm e T = 40°C
d) P = 10 atm e T = 50°C
Resposta correta: alternativa c) P = 100 atm e T = 40°C.
A alternativa c) está correta pois o estado de fluido supercrítico, necessário para o processo, só é alcançado quando a substância está acima de sua pressão e temperatura críticas.
Pelo diagrama, o ponto crítico (PC) do CO₂ está em P ≈ 73 atm e T ≈ 31°C.
A condição de 100 atm e 40°C é a única que satisfaz ambos os critérios, estando localizada na região do fluido supercrítico.
As outras alternativas representam:
- a) ponto de sublimação em pressão atmosférica (gelo seco);
- b) o estado líquido;
- d) o estado gasoso.
Questão 7
Os supercondutores, materiais que conduzem eletricidade sem resistência, precisam ser resfriados a temperaturas extremamente baixas.
Em máquinas de ressonância magnética (MRI), isso é feito imergindo os ímãs supercondutores em hélio líquido.
O hélio é a única substância que permanece líquida até o zero absoluto (0 K) em pressão atmosférica, uma propriedade quântica única.
Um técnico de manutenção de um hospital está analisando o diagrama de fases do hélio para entender os protocolos de segurança e reabastecimento do sistema de refrigeração da máquina de MRI.
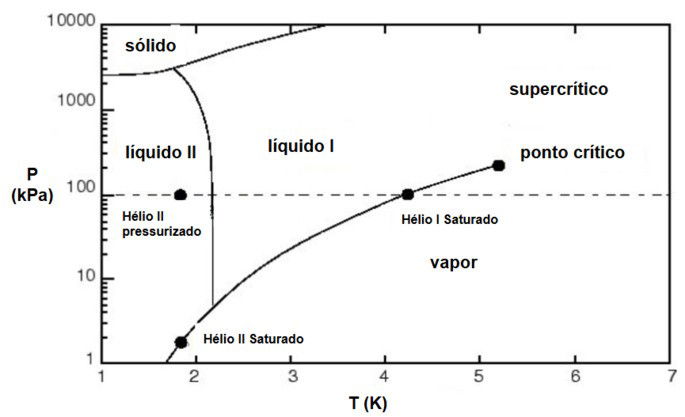
Com base na análise do diagrama de fases do hélio, qual conclusão é correta sobre o comportamento desta substância?
a) A máquina de MRI deve operar a uma pressão abaixo de 1 atm para garantir que o hélio permaneça no estado líquido e não evapore.
b) Semelhante à água, para solidificar o hélio é suficiente resfriá-lo a uma temperatura próxima de 0 K, mantendo a pressão atmosférica constante.
c) A fase superfluida (Líquido I) é menos densa que a fase líquida normal (Líquido II), explicando por que ela ocorre em temperaturas mais baixas.
d) Para transformar hélio líquido em hélio sólido, é necessário não apenas resfriá-lo, mas também submetê-lo a uma pressão superior a 25 atm ou 2530 kPa.
Resposta correta: alternativa d) Para transformar hélio líquido em hélio sólido, é necessário não apenas resfriá-lo, mas também submetê-lo a uma pressão superior a 25 atmou 2530 kPa.
A alternativa d) está correta e é a conclusão mais importante que se pode tirar do diagrama.
A linha de equilíbrio entre as fases sólida e líquida só começa em uma pressão de aproximadamente 25 atm que é igual a 2530 kPa.
Isso significa que, em pressões mais baixas (como a atmosférica, 1 atm), o hélio nunca solidifica, não importa o quão baixa seja a temperatura.
Para obter hélio sólido, é obrigatório aplicar uma pressão muito alta.
As outras alternativas estão incorretas:
a) a 1 atm o hélio ferve a 4.2 K, então é preciso mantê-lo abaixo dessa temperatura;
b) é o oposto do que o gráfico mostra;
c) as temperaturas das fases superfluida e líquida normal estão ao contrário.
Para mais exercícios:
Exercícios sobre escalas termométricas (com gabarito comentado)
Exercícios de Física para 2º ano do Ensino Médio (com questões resolvidas)
SOUTO, Ana. Exercícios sobre diagramas de fases (com gabarito explicado). Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/exercicios-sobre-diagramas-de-fases-com-gabarito-explicado/. Acesso em:


