Fórmula Estrutural: o que é, tipos e exercícios
A fórmula estrutural é o esquema que indica a estrutura, ou seja, a disposição dos átomos de elementos químicos que compõem a cadeia, bem como a ligação entre eles.
Para demonstrar a ligação entre os átomos, utilizam-se traços para simbolizar os elétrons compartilhados em cada ligação.
Por exemplo, a água (H2O) é uma molécula formada por um átomo de oxigênio e dois átomos de hidrogênio. A sua fórmula estrutural é H — O — H.
Os compostos químicos podem ser representados através de três diferentes fórmulas: plana, condensada ou eletrônica.
Dentre os fatores que condicionam as estruturas utilizadas, o número de elétrons na camada de valência é um deles.
Fórmula estrutural plana
A fórmula plana utiliza traços para representar as ligações covalentes, as quais podem ser simples, dupla ou tripla e representadas das seguintes formas:
Ligação simples (quando 2 elétrons são compartilhados)
Representação na estrutura: —
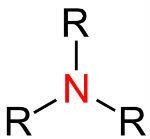
No exemplo acima, um átomo de nitrogênio (N) realiza três ligações simples (—).
Ligação dupla (quando 4 elétrons são compartilhados)
Representação na estrutura:
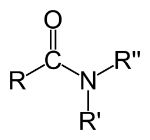
No exemplo acima, o átomo de oxigênio (O) realiza uma ligação dupla (=), enquanto os átomos de carbono (C) e nitrogênio (N) se ligam por ligações simples (—).
Ligação tripla (quando 6 elétrons são compartilhados)
Representação na estrutura:
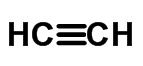
Os átomos de carbono (C) acima são ligados por uma ligação tripla (). Como o carbono é tetravalente, ou seja, se torna estável com quatro ligações químicas, cada átomo ainda faz uma ligação simples (—) com átomo de hidrogênio (H).
Fórmula condensada ou simplificada
Na fórmula estrutural condensada as ligações não são mostradas.
Na sua representação, a quantidade de átomos de cada elemento é indicada de forma condensada, ou seja, simplificada:
H3C — CH2 — O — CH2 —CH3
Fórmula condensada linear
A fórmula condensada linear utiliza linhas em ziguezague, em cujos vértices os carbonos são representados:

Fórmula eletrônica ou de Lewis
A fórmula eletrônica, também chamada de fórmula de Lewis, é representada por pontos. Através desses pontos é que são mostradas as quantidades dos elétrons presentes nas camadas de valência.
Por exemplo, a molécula de hidrogênio (H2) é formada por dois átomos de hidrogênio unidos por uma ligação simples. A fórmula de Lewis para o composto é H:H.
Já a ligação dupla que une dois átomos na molécula de oxigênio (O2) são representados através da fórmula de Lewis da seguinte maneira O::O.
E a fórmula molecular?
A fórmula molecular, sem fazer referência a sua estrutura, indica a quantidade de elementos que compõem uma molécula. Além do que indica o número de átomos presentes em cada elemento e as suas proporções.
Ela pode ser obtida através da fórmula mínima ou empírica e da fórmula percentual ou centesimal.
Por exemplo, a fórmula molecular da glicose é C6H12O6.
Exercícios sobre fórmulas químicas
Questão 1
(Vunesp-2000) Escreva a fórmula estrutural e dê o nome oficial de:
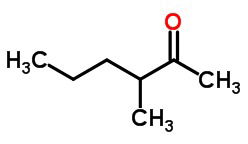
a) uma cetona, de cadeia carbônica ramificada saturada, com o total de 7 átomos de carbono.
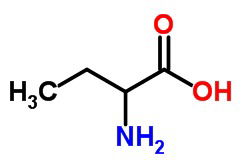
b) um aminoácido, com 4 átomos de carbono.
Questão 2
(FGV-2005) O aspartame é um adoçante artificial que foi descoberto acidentalmente em 1965 por um químico descuidado, que lambeu os seus dedos sujos e sentiu que eles estavam doces.
Esses hábitos não higiênicos não são recomendados, já que muitas substâncias em quantidades ínfimas são altamente tóxicas.
A fórmula estrutural do aspartame é representada a seguir:
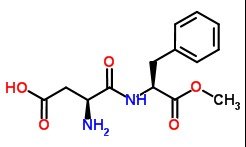
A partir da fórmula estrutural do aspartame, verifica-se que há
a) 13 átomos de carbono por molécula
b) 1 grupo funcional éter
c) 1 dipeptídeo
d) 2 átomos de carbono terciário
e) somente 1 átomo de carbono assimétrico
Para continuar testando seus conhecimentos, veja também essas listas de exercícios:
Referências Bibliográficas
BROWN, T.; LEMAY, H. E.; BURSTEN, B. E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.
HUMISTON, G. E.; BRADY, J. Química Geral, vol. 1, 3ª ed., Rio de Janeiro: LTC, 2008.
BATISTA, Carolina. Fórmula Estrutural: o que é, tipos e exercícios. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/formula-estrutural/. Acesso em: