Titânio (Ti): o que é, para que serve e dados do metal
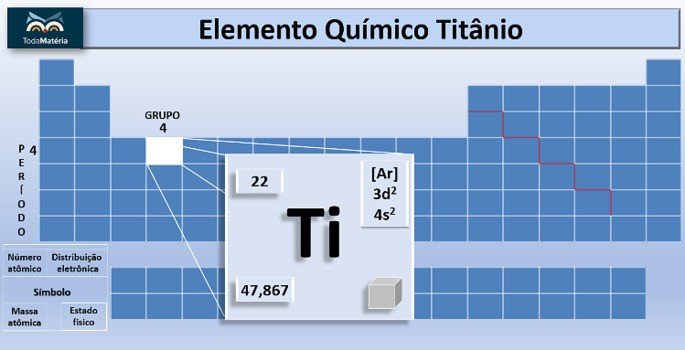
O titânio é o elemento químico de símbolo Ti e número atômico, ou seja, número de prótons igual a 22. Esse metal está localizado no grupo 4 e no 4º período da tabela periódica.
A massa atômica do elemento é 47,867 u e, por ter 22 elétrons na eletrosfera do átomo, sua distribuição eletrônica é 1s2 2s2 2p6 3s2 3p6 4s2 3d2.
O titânio apresenta propriedades desejáveis para inúmeras aplicações, já que é tão forte quanto o aço e muito mais leve.
Por ser um metal dúctil, refratário, resistente à corrosão, apresentar resistência mecânica, estabilidade térmica e baixa reatividade, ele é adicionado a ligas metálicas para que tenham um alto desempenho. A sua biocompatibilidade e não toxicidade também o tornam útil para confecção de próteses ósseas.
As principais características do titânio são:
- Ponto de fusão: 1668 °C
- Ponto de ebulição: 3287 °C
- Densidade: 4,5 g/cm3
- Cor: cinza prateada
- Estado físico a 20 ºC: sólido
- Isótopos: Ti46, Ti47, Ti48, Ti49 e Ti50
Esse elemento químico foi descoberto pelo inglês William Gregor em 1791 e seu nome, derivado do grego titans, foi atribuído posteriormente por Martin Heinrich Klaproth.
O titânio é o nono elemento mais abundante no planeta e é encontrado na crosta terrestre em minérios, como o rutilo (TiO2) e a Ilmenita (FeTiO3). Por isso, a mineração é o principal método de obtenção desse metal.
Para que serve o titânio?
Por ser pouco reativo quimicamente em temperatura ambiente, facilmente moldado, apresentar elevada resistência mecânica e corrosão, o titânio é utilizado como metal estratégico.
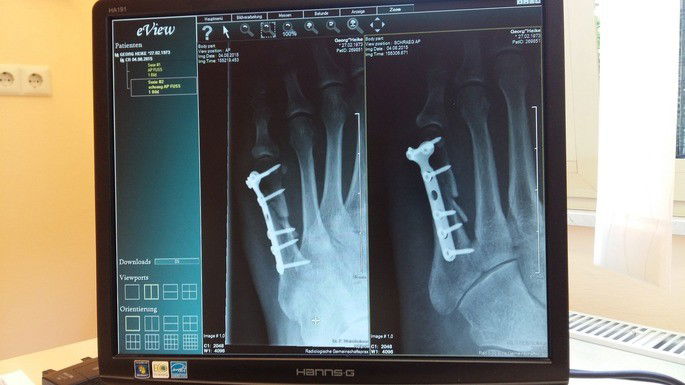
As indústrias de aviação e aeroespacial são as principais utilizadoras de titânio para produção de peças, como componente de turbinas e fuselagem. Outras aplicações são confecção de próteses dentárias, implantes cirúrgicos e joias.
Na medicina, o titânio é bastante útil por causa da sua compatibilidade com os tecidos humanos, leveza e resistência. Ele é utilizado para produção de implantes para partes do corpo, como parafusos de fixação, substituição de articulação de joelho, prótese para úmero, prótese para quadril, entre outros.
O dióxido de titânio (TiO2) é um dos principais compostos desse elemento, sendo utilizado como agente clareador. Geralmente, tintas brancas de alta qualidade o utilizam para melhorar o aspecto visual de cor e brilho. Outros produtos, como cremes dentais e protetores solares, também utilizam o pigmento. Há ainda a aplicação como corante alimentar adicionado em laticínios, doces e bebidas.
Na arquitetura, podemos observar a utilização do titânio no recobrimento das estruturas curvas do Museu Guggenheim, em Bilbao, no norte da Espanha.

No cotidiano podemos encontrar inúmeros produtos que apresentam titânio na composição, como quadro de bicicleta, armação de óculos e raquetes de tênis.
Na indústria química, o titânio é utilizado como catalisador de reações. Desse modo, ele possibilita o controle da velocidade de reação e diminui o tempo de formação dos produtos sem afetar a composição das substâncias.
A indústria automobilística tem estudado a incorporação de titânio na fabricação de carros para diminuir a sua massa e, assim, diminuir o consumo de combustível e aumentar sua aceleração.
Adquira mais conhecimento com os conteúdos:
Referências Bibliográficas
ATKINS, P.W.; JONES, L. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006.
FELTRE, R. Fundamentos de Química: vol. único. 4ª.ed. São Paulo: Moderna, 2005.
Lee, J. D. Química inorgânica não tão concisa. Tradução da 5ª ed. inglesa. Editora Edgard Blücher Ltda. 1999.
BATISTA, Carolina. Titânio (Ti): o que é, para que serve e dados do metal. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/titanio/. Acesso em:



