Metais: o que são, exemplos e propriedades
Metal é um elemento que facilmente perde elétrons e forma espécies positivas. Além disso, apresenta características intrínsecas, como brilho reflexivo, resistência, alto ponto de fusão e capacidade de conduzir eletricidade e calor.
A maior parte dos elementos químicos são classificados como metais e ocupam cerca de dois terços da Tabela Periódica.
Os metais apresentam várias aplicações e estão presentes em diversos materiais utilizados no dia a dia, que vão desde o suporte estrutural em construções até equipamentos médicos essenciais.
Essa classe de substâncias é comumente encontrada na forma de minérios, no solo e em rochas, ou livres na natureza.
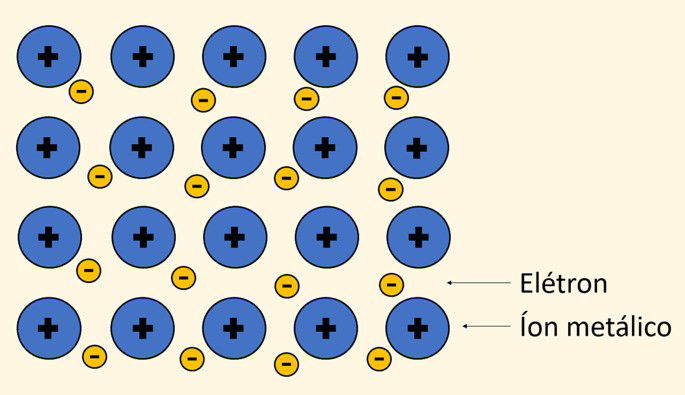
Na imagem a seguir está representada a estrutura de um metal. Os elétrons mais externos dos átomos são liberados e se movimentam livremente entre os íons positivos (cátions) formados.
Exemplos de metais
Os metais com maiores aplicações no cotidiano são divididos em ferrosos e não ferrosos.
Os metais ferrosos são constituídos de ferro, o metal mais utilizado no mundo, isolado ou combinado com outros materiais na forma de liga.
As ligas metálicas são misturas formadas por pelo menos um metal e outros elementos químicos. O aço, por exemplo, é formado por cerca de 98% de ferro, pequenas quantidades de carbono e traços de outros elementos, como níquel, enxofre e fósforo.
São exemplos de metais não ferrosos:
- Cobre: primeiro metal utilizado pelo homem
- Alumínio: metal mais abundante na crosta terrestre
- Tungstênio: metal mais forte do mundo
- Ródio: metal mais caro do mundo
- Estanho: metal resistente à corrosão
- Cálcio: metal mais abundante no corpo humano
- Zinco: metal que participa de diversas reações químicas no organismo
- Titânio: metal mais biocompatível
- Mercúrio: único metal líquido em condições ambientes
- Frâncio: metal com a maior capacidade de perder elétrons
- Césio, polônio e tório: metais radioativos
- Ouro, prata, platina, paládio e irídio: metais preciosos
- Chumbo, arsênio, cádmio, antimônio e cromo: metais pesados
O microlattice, constituído de níquel e fósforo, é o metal mais leve do mundo e tem peso 100 vezes menor que o isopor.
Saiba mais sobre as ligas metálicas.
Propriedades dos metais
O caráter metálico corresponde à capacidade de perder elétrons na camada mais externa do átomo. Os metais facilmente perdem elétrons, que se movem livremente na estrutura e originam diversas propriedades.
As propriedades mecânicas estão relacionadas com a estrutura cristalina do metal e as principais são:
- Dureza: capacidade de resistir ao ser riscado ou penetrado por outro material.
- Maleabilidade: capacidade de ser moldado ou sofrer deformação sem quebrar.
- Ductilidade: capacidade de ser moldado em fios sem que haja rompimento.
- Condutividade: capacidade de conduzir eletricidade e calor.
- Fusibilidade: capacidade de derreter ou fundir mediante a aplicação de calor.
- Resistência ao estresse: capacidade de suportar a aplicação de forças abrasivas sem perda de material.
Pela capacidade de resistirem ao fogo, os metais são moldados para produção de instrumentos e materiais em diferentes áreas.
A reatividade é uma propriedade química variável entre os metais. Metais pouco reativos, como prata e ouro, são utilizados na confecção de joias. Entretanto, existem metais muito reativos, como o sódio e o potássio, que no estado puro e em contato com a água formam uma reação explosiva.
Metais na Tabela Periódica
Ao todo, existem 91 metais conhecidos e eles estão distribuídos ao centro e mais à esquerda na Tabela Periódica.
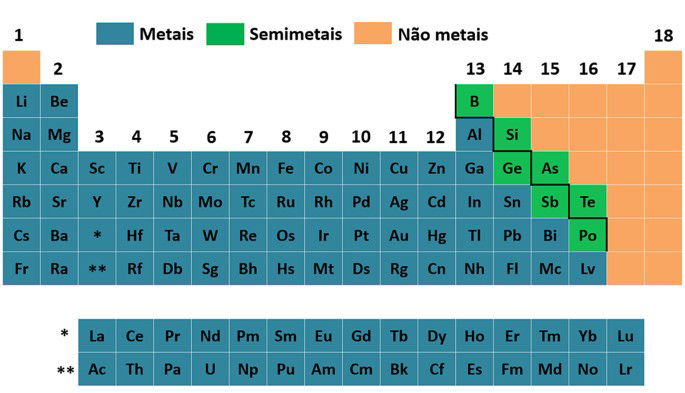
Metais alcalinos (grupo 1): lítio (Li), sódio (Na), potássio (K), rubídio (Rb), césio (Cs) e frâncio (Fr).
Metais alcalinoterrosos (grupo 2): berílio (Be), magnésio (Mg), cálcio (Ca), estrôncio (Sr), bário (Ba) e rádio (Ra).
Metais representativos: alumínio (Al), gálio (Ga), índio (In), tálio (Tl), niônio (Nh), estanho (Sn), chumbo (Pb), fleróvio (Fl), bismuto (Bi), moscóvio (Mc) e livermório (Lv), distribuídos entre os grupos de 13 a 16, além dos metais alcalinos e alcalinoterrosos.
Metais de transição são os metais localizados no centro da tabela periódica nos grupos de 3 a 12:
- Grupo 3: escândio (Sc), ítrio (Y), sério de lantanídeos* e actinídeos**
- Grupo 4: titânio (Ti), zircônio (Zr), háfnio (Hf) e rutherfórdio (Rf)
- Grupo 5: vanádio (V), nióbio (Nb), tântalo (Ta) e dúbnio (Db)
- Grupo 6: cromo (Cr), molibdênio (Mo), tungstênio (W) e seabórgio (Sg)
- Grupo 7: manganês (Mn), tecnécio (Tc), rênio (Re) e bóhrio (Bh)
- Grupo 8: ferro (Fe), rutênio (Ru), ósmio (Os) e hássio (Hs)
- Grupo 9: cobalto (Co), ródio (Rh), irídio (Ir) e meitnério (Mt)
- Grupo 11: cobre (Cu), prata (Ag), ouro (Au) e roentgênio (Rg)
- Grupo 12: zinco (Zn), cádmio (Cd), mercúrio (Hg) e copernício (Cn)
*A série de lantanídeos é formada por lantânio (La), cério (Ce), praseodímio (Pr), neodímio (Nd), promécio (Pm), samário (Sm), európio (Eu), gadolínio (Gd), térbio (Tb), disprósio (Dy), hólmio (Ho), érbio (Er), túlio (Tm), itérbio (Yb) e lutécio (Lu).
**A série de actinídeos contém os elementos actínio (Ac), tório (Th), protactínio (Pa), urânio (U), netúnio (Np), plutônio (Pu), amerício (Am), cúrio (Cm), berquélio (Bk), califórnio (Cf), einstéinio (Es), férmio (Fm), mendelévio (Md), nobélio (No) e laurêncio (Lr).
Existem ainda os semimetais boro (B), silício (Si), germânio (Ge), arsênio (As), antimônio (Sb), telúrio (Te) e polônio (Po) que são classificados dessa forma por apresentarem características intermediárias entre metais e não metais.
Confira a localização e mais informações de todos os elementos químicos na Tabela Periódica completa e atualizada.
Obtenção dos metais
A mineração é a prática de extração e beneficiamento de minérios da natureza. A partir desses materiais é que são obtidos os metais.
Para se obter um metal, uma série de etapas são realizadas e o processo basicamente é: pesquisa, extração (lavra), transporte, processamento e beneficiamento.
Os principais minérios de interesse econômico são:
- Minérios de ferro (Fe): magnetita (Fe3O4), hematita (Fe2O3) e pirita (FeS2)
- Minério de alumínio (Al): bauxita (Al2O3)
- Minério de cobre (Cu): calcopirita (CuFeS2)
- Minério de cálcio (Ca): calcita (CaCO3)
- Minério de chumbo (Pb): galena (PbS)
- Minério de zinco (Zn): esfalerita (ZnS)
Saiba mais sobre os minerais.
Diferença entre metais e não metais
Uma das principais distinções entre os elementos químicos metálicos e não metálicos está na afinidade por elétrons. Os metais são os elementos que apresentam a tendência de doar elétrons, enquanto os não metais tendem a recebê-los.
Os metais apresentam elevada eletropositividade, pois apresentam a tendência de doar elétrons. Em contrapartida, os não metais tendem a atrair elétrons e são os mais eletronegativos da tabela.
Os átomos de um metal permanecem unidos em uma ligação metálica por causa dos elétrons livres, que formam um “mar de elétrons” na estrutura.
Átomos de metais e ametais podem se unir através de uma ligação iônica para formar substâncias químicas, pois há a transferência de elétrons, ou seja, o metal doa e o ametal recebe e formam-se espécies com cargas opostas.
Por exemplo, o sal de cozinha, composto químico cloreto de sódio (NaCl), é formado pela união do metal sódio com o ametal cloro.
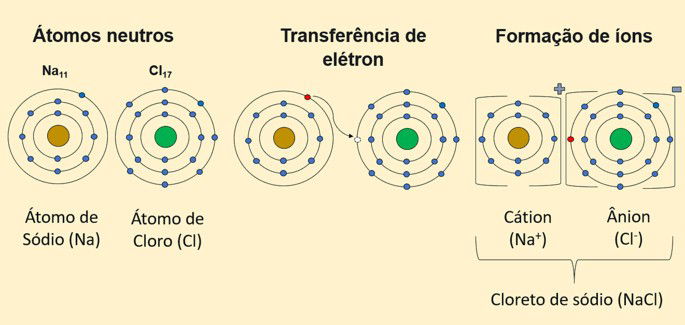
O sódio é um metal do grupo 1 da Tabela Periódica e doa um elétron para adquirir estabilidade. O cloro, que apresenta 7 elétrons na última camada, é um ametal do grupo 17 e se torna estável com o elétron recebido.
Observe que quando um metal doa elétrons, ele se torna um íon positivo (cátion). Já o não metal ao receber elétrons se transforma em um íon negativo (ânion).
Saiba mais sobre ligações metálicas.
Referências Bibliográficas
BROWN, Theodore; LEMAY, H. Eugene; BURSTEN, Bruce E. Química: a ciência central. 9 ed. Prentice-Hall, 2005.
USBERCO, João; SALVADOR, Edgard. Química Geral. 12ª.ed. São Paulo: Saraiva, 2006.
ATKINS, P.W.; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006.
BATISTA, Carolina. Metais: o que são, exemplos e propriedades. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/metais/. Acesso em:



