Nióbio (Nb): o que é, para que serve e onde é encontrado
O nióbio (Nb) é um metal refratário, ou seja, muito resistente ao calor e ao desgaste. É brilhante, de baixa dureza, condutor de eletricidade e resistente à corrosão. Por causa dessas propriedades, o nióbio tem muitas aplicações que vão desde a produção do aço até a fabricação de foguetes.
Está disponível na natureza em minerais, geralmente ligado a outros elementos, principalmente ao tântalo, pois os dois têm propriedades físico-químicas muito próximas.
Trata-se do elemento químico de número atômico 41, pertence ao grupo 5 da Tabela Periódica e é classificado como metal de transição. Ele foi descoberto em 1801 pelo químico britânico Charles Hatchett.
Nióbio no Brasil
A grande quantidade de minérios que contém o nióbio está localizada no Brasil, maior produtor mundial, que detém mais de 90% das reservas do metal.
Na década de 50, a maior jazida do minério pirocloro, contendo esse metal, foi descoberta no Brasil pelo geólogo brasileiro Djalma Guimarães.
As reservas exploradas estão localizadas nos estados de Minas Gerais, Amazonas, Goiás e Rondônia.
Canadá, Austrália, Egito, República Democrática do Congo, Groenlândia, Rússia, Finlândia, Gabão e Tanzânia são exemplos de países que também apresentam minerais com nióbio.
Para que serve o nióbio?
As características do nióbio tornam esse elemento cada vez mais desejado e com inúmeras aplicações.
A principal vantagem de utilizar o nióbio é que apenas uma pequena quantidade pode modificar uma tonelada de ferro. Isso faz com que o metal se torne mais leve, resistente à corrosão e mais eficiente.
Somente a partir de 1905 é que as aplicações para o nióbio começaram a ser investigadas, quando o químico alemão Werner von Bolton produziu o elemento na forma pura.
A década de 50 representou uma grande busca por aplicações do nióbio, pois até então ele não era produzido em grande escala. Nesse período, a Guerra Fria fez despertar o interesse pelo metal para componentes aeroespaciais.
A seguir, apresentamos uma lista das formas como o nióbio é utilizado.
Ligas metálicas
A adição de nióbio a uma liga aumenta a sua temperabilidade, ou seja, a capacidade de endurecer quando exposta ao calor e depois arrefecida. Com isso, o material que contém nióbio pode ser submetido a um tratamento térmico diferenciado.
A afinidade do nióbio com carbono e nitrogênio favorece as propriedades mecânicas da liga, aumentando, por exemplo, a resistência mecânica e a resistência ao desgaste abrasivo. Com isso, pode-se ampliar as aplicações industriais de uma liga.
O aço, por exemplo, é uma liga metálica formada por ferro e carbono. A adição de nióbio a essa liga pode trazer vantagens para:
- Indústria automotiva: produção de um carro mais leve e mais resiste à colisão;
- Construção civil: melhora a soldabilidade do aço e confere maleabilidade;
- Indústria de dutos de transportes: permite construções com paredes mais finas e diâmetros maiores, sem afetar a segurança.
A superliga é uma liga metálica que suporta elevadas temperaturas e apresenta resistência mecânica. Ligas contendo nióbio fazem com que o material seja útil na fabricação de turbinas de aviões ou de produção de energia.
A vantagem de operar em elevadas temperaturas faz com que as superligas componham motores a jato de alto desempenho.
Ímãs supercondutores
A supercondutividade do nióbio faz com os compostos de nióbio-germânio, nióbio-escândio e nióbio-titânio sejam utilizados em:
- Scanner das máquinas de ressonância magnética;
- Aceleradores de partículas, como o Grande Colisor de Hádrons;
- Detecção de radiação eletromagnética e estudo da radiação cósmica por materiais que apresentam nitrito de nióbio.
Óxidos
Outras aplicações para o nióbio são na forma de óxidos, principalmente o Nb2O5. Os principais usos são:
- Lentes óticas;
- Capacitores cerâmicos;
- Sensores de pH;
- Peças de motor;
- Joias.
Minérios de nióbio
O nióbio é encontrado na natureza sempre ligado a outros elementos químicos. Já se tem conhecimento de mais de 90 espécies minerais contendo nióbio e tântalo na natureza.
A seguir, podemos observar alguns minérios, as principais características e o teor de nióbio disponível em cada material.
Columbita-tantalita
Composição: (Fe,Mn)(Nb,Ta)2O6
Teor de nióbio (máximo): 76% de Nb2O5
Características:
- Mineral ortorrômbico;
- Densidade relativa variável de 5,2 a 8,1 g/cm3;
- Forma estruturas semelhantes, nas quais o tântalo e o nióbio se substituem em todas as proporções.
Piroclorita
Composição: (Na2,Ca)2(Nb,Ti)(O,F)7
Teor de nióbio (máximo): 71% de Nb2O5
Características:
- Mineral isométrico de hábito octaédrico;
- Densidade relativa de 4,5 g/cm3;
- Possui a variedade bariopirocloro, que inclui o elemento bário em sua composição.
Loparita
Composição: (Ce,Na,Ca)2(Ti,Nb)2O6
Teor de nióbio (máximo): 20% de Nb2O5
Características:
- Mineral granular a quebradiço;
- Densidade 4,77 g/cm3;
- Cristaliza-se no sistema isométrico.
Exploração do nióbio
Os minérios de nióbio passam por transformações até que sejam formados os produtos que serão comercializados.
As etapas do processo podem ser resumidas em:
- Mineração
- Concentração de nióbio
- Refino de nióbio
- Produtos de nióbio
A mineração ocorre onde estão as reservas de minérios, que são extraídos com o uso de explosivos e transportados por correias para onde ocorre a etapa de concentração.
A concentração ocorre com a desagregação do minério, a moagem faz com que seus cristais se tornem bem mais finos e utilizando a separação magnética as frações de ferro são removidas.
No refino do nióbio ocorre a remoção de teores de enxofre, água, fósforo e chumbo.
Um dos produtos contendo o nióbio é a liga ferro-nióbio, que é produzida conforme a equação a seguir:
Esse processo é chamado de aluminotermia em que o concentrado do minério é misturado em reatores com sucata de ferro ou óxido de ferro.
Os óxidos metálicos reagem com o alumínio sob elevadas temperaturas, gerando o produto de interesse.
Os produtos mais comercializados de nióbio são:
- Concentrados de nióbio: uma base que contém 58% de Nb2O5.
- Liga de ferro-nióbio: contém 65% de nióbio.
- Óxido de alta pureza: utilizado na produção de materiais especiais.
Saiba mais sobre metais.
História e descoberta do Nióbio
Em 1734 alguns minérios pertencentes a uma coleção pessoal de John Winthrop foram levados da América para Inglaterra e esses artigos fizeram parte do acervo do Museu Britânico em Londres.
Ao ingressar na Royal Society, o químico britânico Charles Hatchett concentrou-se em investigar a composição dos minérios disponíveis no museu. Foi assim que em 1801 ele isolou um elemento químico, na forma de óxido, e atribui-lhe o nome de colúmbio e o minério de onde foi extraído de columbita.
Em 1802, o químico sueco Anders Gustaf Ekeberg comunicou a descoberta de um novo elemento químico e nomeou-o de tântalo, em referência ao filho de Zeus da mitologia grega.
Em 1809, o químico e físico inglês William Hyde Wollaston analisou esses dois elementos e observou que eles tinham características muito próximas.
Devido a esse fato, de 1809 a 1846, o colúmbio e o tântalo foram considerados o mesmo elemento.
Mais tarde, o mineralogista e químico alemão Heinrich Rose ao investigar o minério columbita observou que o tântalo também estava presente.
Rose constatou a presença de outro elemento, semelhante ao tântalo e chamou-o de Nióbio, em referência a Niobe, filha de Tântalo, da mitologia grega.
Em 1864, o sueco Christian Bromstrand conseguiu isolar o nióbio de uma amostra de cloreto aquecido em atmosfera de hidrogênio.
Em 1950, a União de Química Pura e Aplicada (IUPAC) aprovou o nióbio como sendo o nome oficial, ao invés de colúmbio, pois se tratavam do mesmo elemento químico.
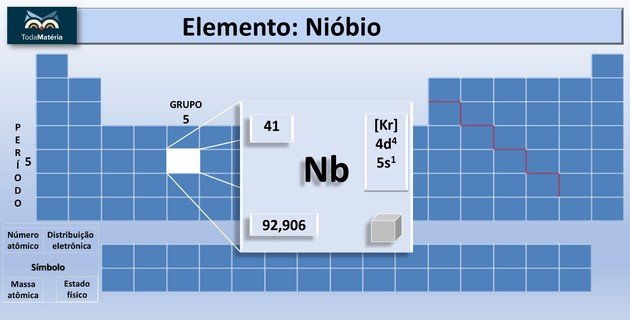
Nióbio na Tabela Periódica
Propriedades físicas do Nióbio
| Estado físico | sólido a temperatura ambiente |
|---|---|
| Cor e aparência | cinzento metálico |
| Densidade | 8,570 g/cm3 |
| Ponto de fusão | 2468 ºC |
| Ponto de ebulição | 4742 ºC |
| Estrutura cristalina | Cúbica de Corpo Centrado - CCC |
|
Condutividade térmica |
54,2 W m-1 K-1 |
Propriedades químicas do Nióbio
| Classificação | Metal de transição | ||
|---|---|---|---|
| Número atômico | 41 | ||
| Bloco | d | ||
| Grupo | 5 | ||
| Período | 5 | ||
| Peso atômico | 92,90638 u | ||
| Distribuição eletrônica |
1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d3 5s2 |
||
| Raio atômico | 1,429 Å | ||
| Íons comuns |
Nb5+ e Nb3+ |
||
| Eletronegatividade | 1,6 Pauling |
Resumo sobre o Nióbio
Elemento químico: Nióbio |
|||
|---|---|---|---|
| Símbolo | Nb | Descobridor | Charles Hatchett |
| Número atômico | 41 | Massa atômica | 92.906 u |
| Grupo | 5 | Período | 5 |
| Classificação | Metal de transição | Distribuição eletrônica | [Kr]4d35s2 |
| Características |
|
||
| Principais minérios |
|
||
| Principais produtos |
|
||
| Aplicações |
|
||
| Ocorrência | No mundo |
|
|
| No Brasil |
|
||
Exercícios sobre Nióbio
Questão 1
(Enem/2018) Na mitologia grega, Nióbia era a filha de Tântalo, dois personagens conhecidos pelo sofrimento. O elemento químico de número atômico (Z) igual a 41 tem propriedades químicas e físicas tão parecidas com as do elemento de número atômico 73 que chegaram a ser confundidos.
Por isso, em homenagem a esses dois personagens da mitologia grega, foi conferido a esses elementos os nomes de nióbio (Z = 41) e tântalo (Z = 73). Esses dois elementos químicos adquiriram grande importância econômica na metalurgia, na produção de supercondutores e em outras aplicações na indústria de ponta, exatamente pelas propriedades químicas e físicas comuns aos dois.
KEAN, S. A colher que desaparece: e outras histórias reais de loucura, amor e morte a partir dos elementos químicos. Rio de Janeiro: Zahar, 2011 (adaptado).
A importância econômica e tecnológica desses elementos, pela similaridade de suas propriedades químicas e físicas, deve-se a
a) terem elétrons no subnível f.
b) serem elementos de transição interna.
c) pertencerem ao mesmo grupo na tabela periódica.
d) terem seus elétrons mais externos nos níveis 4 e 5, respectivamente.
e) estarem localizados na família dos alcalinos terrosos e alcalinos, respectivamente.
Questão 2
(IFPE/2018) O Brasil é o maior produtor mundial de nióbio, respondendo por mais de 90% da reserva desse metal. O nióbio, de símbolo Nb, é empregado na produção de aços especiais e é um dos metais mais resistente à corrosão e a temperaturas extremas. O composto Nb2O5 é o precursor de quase todas as ligas e composto nióbio. Assinale a alternativa com a massa necessária de Nb2O5 para a obtenção de 465 gramas de nióbio. Dado: Nb = 93 g/mol e O = 16 g/mol.
a) 275 g
b) 330 g
c) 930 g
d) 465 g
e) 665 g
Questão 3
(UECE/2015) O Brasil detém 98% das reservas mundiais de nióbio, que apresenta numerosas aplicações industriais como, por exemplo, em fabricação de joias, implantes hiperalergênicos, eletrocerâmicas, imãs supercondutores, máquinas de ressonância magnética, ligas metálicas, moedas especiais e na produção de aço. Sobre o nióbio, analise as afirmações abaixo e assinale a única alternativa verdadeira.
a) Seu elétron diferencial se localiza na penúltima camada.
b) Trata-se de um elemento representativo.
c) Sua eletronegatividade é inferior à do vanádio.
d) Pertence ao quarto período da tabela periódica.
Questão 4
(UEA/2014) O isótopo natural do nióbio é o 93Nb. O número de nêutrons desse isótopo é
a) 41.
b) 52.
c) 93.
d) 134.
e) 144.
Questão 5
(IFMG/2015) O elemento químico nióbio, Nb, tem seu nome derivado da deusa grega Niobe. O Brasil é o maior produtor mundial do metal, sendo responsável por 75% da produção. Devido à estabilidade térmica de suas ligas, o nióbio é utilizado na produção de ligas de aço especiais de alta resistência para motores, equipamentos de propulsão e vários materiais supercondutores. Observando a posição do nióbio na tabela periódica, é correto afirmar que:
a) seu subnível mais energético será o subnível d.
b) é um elemento pertencente à família dos metais alcalinos.
c) forma compostos iônicos com outros metais.
d) seus cátions terão raio atômico maior que o elemento puro.
Questão 6
(UFSC/2003) O nióbio foi descoberto em 1801, pelo químico inglês Charles Hatchett. O Brasil detém cerca de 93% da produção mundial de concentrado de nióbio. As maiores jazidas localizam-se nos estados de Minas Gerais, Goiás e Amazonas. O metal é utilizado sobretudo na fabricação de ligas ferro-nióbio e de outras ligas mais complexas, que têm sido aplicadas na construção de turbinas de propulsão a jato, foguetes e naves espaciais. Seus óxidos são utilizados na confecção de lentes leves para óculos, câmeras fotográficas e outros equipamentos ópticos. Dado (Z = 41). A respeito do nióbio, assinale a(s) proposição(ões) CORRETA(S).
(01) O nióbio, ao perder 3 elétrons, assume a configuração do criptônio.
(02) O nióbio pode formar óxidos metálicos do tipo M2O5 e M2O3.
(04) O símbolo químico do nióbio é Ni.
(08) O nióbio é um metal de transição.
(16) Uma liga ferro-nióbio é um exemplo de solução sólida.
Questão 7
(UERJ/2013) O nióbio é um metal encontrado em jazidas naturais, principalmente na forma de óxidos.
Em uma jazida que contenha nióbio com número de oxidação +5, a fórmula do óxido predominante desse metal corresponde a:
a) NbO5
b) Nb5O
c) Nb5O2
d) Nb2O5
Leia o texto para responder às questões de números 8 a 10.
O nióbio é um metal de grande importância tecnológica e as suas principais reservas mundiais se localizam no
Brasil, na forma do minério pirocloro, constituído de Nb2O5. Em um dos processos de sua metalurgia extrativa, emprega-se a aluminotermia na presença do óxido Fe2O3, resultando numa liga de nióbio e ferro e óxido de alumínio como subproduto. A reação desse processo é representada na equação:
Na natureza, o nióbio se apresenta na forma do isótopo estável nióbio-93, porém são conhecidos diversos isótopos sintéticos instáveis, que decaem por emissão de radiação. Um deles é o nióbio-95 que decai para o elemento molibdênio-95.
(Sistemas.dnpm.gov.br ; Tecnol. Metal. Mater. Miner., São Paulo, v. 6, n. 4, p. 185-191, abr.-jun. 2010 e G. Audi et al./Nuclear Physics A 729 (2003) 3–128. Adaptado)
Questão 8
(FGV/2019) Na reação de aluminotermia com obtenção da liga de nióbio e ferro, considerando-se a estequiometria apresentada na equação balanceada, o total de elétrons envolvidos no processo é
a) 6.
b) 12.
c) 18.
d) 24.
e) 36.
Questão 9
(FGV/2019) Em uma operação de aluminotermia para produção de liga de nióbio e ferro com quantidades estequiométricas de Nb2O5 e Fe2O3 e emprego de excesso de alumínio metálico, formaram-se 6,12 toneladas de Al2O3. O total da soma das quantidades, em mols, de nióbio e ferro estimadas para serem obtidas nessa operação é
a) 6 × 104
b) 6 × 106
c) 8 × 103
d) 8 × 104
e) 8 × 106
Questão 10
(FGV/2019) A figura apresenta a curva de decaimento radiativo de uma amostra de nióbio-95, que decai para molibdênio-95.

No processo de decaimento do radioisótopo nióbio-95, o tempo decorrido para que a atividade dessa amostra decaia para 25 MBq e o nome das espécies emitidas são
a) 140 dias e nêutrons.
b) 140 dias e prótons.
c) 120 dias e prótons.
d) 120 dias e partículas ß–.
e) 140 dias e partículas ß–.
Referências Bibliográficas
ATKINS, P.W.; JONES, Loretta. Princípios de química: questionando a vida moderna e o meio ambiente. 3.ed. Porto Alegre: Bookman, 2006.
FELTRE, Ricardo. Fundamentos de Química: vol. único. 4ª.ed. São Paulo: Moderna, 2005.
Lee, J. D. Química inorgânica não tão concisa. Tradução da 5ª ed. inglesa. Editora Edgard Blücher Ltda. 1999.
BATISTA, Carolina. Nióbio (Nb): o que é, para que serve e onde é encontrado. Toda Matéria, [s.d.]. Disponível em: https://www.todamateria.com.br/niobio/. Acesso em: